您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-24 20:46
前言
运动和感觉功能对人类至关重要,随着社会发展和老龄化程度逐年加剧,以脑卒中、脑瘫、脊髓损伤等为代表的各类运动和感觉功能障碍发病率居高不下,针对性的康复干预尤为重要。基于物理因子的神经刺激调控技术辅助运动和感觉康复已成为国际学术和应用研究的前沿和热点方向,采用电磁光声等物理刺激调节与感觉运动功能相关神经回路,可促进运动和感觉康复。现有物理因子康复干预技术的作用机制仍不明确,最优干预参数仍待研究。
神经刺激调控技术需要平衡刺激靶点的特异性、侵入性和患者可接受性,并根据不同患者需求定制个性化康复干预方案,也需要临床医生与多学科研究人员的密切合作。联合应用神经影像学及电生理技术,采用闭环控制方法,可有助于制定更为有效的康复干预方案,新技术、新材料、新方法的出现也将促进物理因子干预技术不断发展。
#1、物理因子与运动和感觉功能康复治疗
自然灾害、出生缺陷、疾病及意外事故等可导致人体运动和感觉功能障碍,随着社会发展和老龄化,各类运动和感觉功能障碍发病率居高不下。典型的运动和感觉功能障碍诱因包括脑卒中、脊髓损伤、脑瘫、帕金森、截肢、特发性震颤、共济失调等。这些疾病不仅严重影响了患者的日常工作生活,也显著增加了家庭和社会负担。人体神经感觉运动控制系统主要涉及中枢和外周神经系统,大脑、小脑、基底核、丘脑、脑干、脊髓、肌肉、骨骼、躯干等都深度参与这一过程,涉及复杂的神经控制环路和交互作用。不同层次的损伤和缺陷等都可能导致各类运动和感觉功能障碍[1],如图1。中枢调控和外周刺激都可用于运动和感觉障碍的康复干预。
基于各种物理因子的神经刺激调控技术辅助运动和感觉康复已成为国际学术和应用研究的前沿和热点方向。电、磁、光、声、冷、热或其他信号被传送并且作用到运动和感觉系统的特定部位(中枢或外周神经等),以辅助运动和感觉障碍的治疗康复。本文将从电磁光声四方面展开讨论,目前经颅电刺激、经颅磁刺激、脑深部电刺激、神经肌肉电刺激等电磁刺激应用最为广泛,而光刺激、超声刺激等新型刺激仍在发展中。根据是否需要手术植入可分为侵入性和非侵入性神经调控方法,侵入式方法通常有更好的靶点特异性但需要有创手术,非侵入方法避免了有创手术带来的感染风险,副作用轻微,且患者耐受性好,但靶向性差、常需要多次重复刺激。不同的神经刺激调控方法的使用需要平衡刺激靶点的特异性、侵入性和被试可接受性,根据不同患者的需求定制个性化的刺激调控方案[2]。目前美国食品药品监督管理局(FDA)通常根据各干预技术及其适应症来进行单独批复,需要严谨的临床实验依据支撑。

图1 神经感觉运动控制结构及各类运动和感觉障碍
#2、电磁刺激
继1870年德国科学家报道了电刺激犬的大脑皮层可引发特定的躯体反应,电刺激逐步应用于临床。而磁刺激基于法拉第电磁感应原理,其本质仍是通过交变磁场引起的电场变化来完成靶向刺激,因此本文统称电磁刺激。如图2所示,电磁刺激具体可分为经颅电刺激、经颅磁刺激、深部电刺激、硬膜外刺激、经颅小脑电刺激、迷走神经电刺激、经脊髓电刺激、神经肌肉电刺激、经皮电刺激等[3]。图3给出了各中枢刺激模式的时间和空间分辨率情况,其侵入性也做了相应标识。
中枢刺激
· 经颅电刺激
经颅电刺激技术(Transcranial electrical stimulation,tES)利用片状电极施加低强度直流电刺激(tDCS,0.5~+2 mA)特定大脑区域,可改变神经元的静息电位和大脑皮质的兴奋性,并引起生理行为学改变,其中阳极刺激提高皮层神经元兴奋性而阴极刺激降低兴奋性。tDCS影响持续时间从几十分钟、几个小时甚至长达几个月,这一效应与tDCS影响突触连接功能、改变突触可塑性有关,神经可塑性是经颅电刺激应用于人体运动和认知康复领域的理论基础。
经颅交流电刺激(tACS)采用正弦交流电用于刺激大脑,不同频率刺激可产生不同效果。经颅电刺激具有良好的生物安全性、耐受性和便携性,适合不同层次的患者,有着广泛的应用前景[4]。目前美国FDA已经批准Soterix、Neuroelectrics等多个tES设备应用于抑郁症等认知领域,且可居家使用,但目前尚未批准应用于运动功能障碍。目前国内NMPA已将其作为二类医疗器械纳入监管,并批准了相关产品。

图2 典型电磁刺激模式
传统经颅电刺激分辨率较低,难以精准刺激靶区,且刺激电极的位置也会影响调控效果,目前已逐步发展到多通道的高精度电刺激(HD-tES)以及更高通道的网络式(Network-tES)电刺激。基于有限元等计算模型,研究颅内电场分布,可利用最优化算法确定最优靶点及刺激方案。经颅电刺激可引起脑功能变化,但由于设备限制,以往只能在电刺激之后采集脑电图(EEG)、近红外光谱(fNIRS)、功能磁共振成像(fMRI)等,再进行脑信号采集和离线数据分析,难以实时定量评估刺激效果,同步EEG-tES和fNIRS-tES采集系统能够提升刺激效果定量评价的有效性。传统的电刺激仪器常采用开环模式,设定刺激参数后不再改变,而闭环神经刺激能同时完成神经电生理监测与电刺激,用于监测脑功能的变化情况,信号分析结果能实时反馈到电刺激仪器,并根据结果调整动态刺激参数。刺激过程中电生理信号难免引入伪迹,发展高性能的去噪和自适应闭环控制算法能够进一步提高系统有效性[5]。
脑卒中运动功能康复依赖于神经可塑性及脑功能的重组,通过刺激不同脑功能部位,如刺激患侧运动区、抑制健侧运动区等。tES对刺激脑区兴奋性的促进和抑制作用,使其能够平衡中风患者患病脑半球与非患病脑半球的活动强度。将tES与任务相关的运动训练联用,可有效促进卒中后运动学习和康复,但目前仍缺乏现有大规模随机对照实验验证,个体间、群体间差异仍较为显著。不同卒中阶段、感觉运动损伤程度、刺激参数等都可能影响康复效果,针对患者个性化的参数设置等需要进一步探索[6]。如将电刺激放置小脑、脊髓等位置,也可发挥不同的作用,如小脑经颅电刺激已经应用于脑卒中后神经可塑性、站立平衡等的康复训练,主要调节了小脑和大脑之间的关系,而脊髓电刺激则可结合康复机器人参与训练,这部分主要是通过中枢神经系统内部的相互调节作用等来实现。此外tES也开始应用于脑瘫、帕金森等感觉运动功能障碍的康复干预。
初步结果显示阳极tDCS能够有效提高脑瘫患者下肢功能,尤其在步态、活动度和平衡功能等方面,但都缺乏大规模随机对照实验和长期随访,而在上肢方面仍缺乏证据证明其有效性。1989年,美国食品和药物管理局(FDA)批准了脊髓电刺激疗法,用于缓解躯干、手臂或腿部神经损伤带来的疼痛,目前已占到所有神经调节疗法的90%。针对帕金森步态冻结症状,有双盲随机对照实验通过多次刺激初级运动皮层和背外侧前额叶皮质等区域,可减轻轻度及中度患者的步态冻结症状。而其他相关疾病如张力障碍、共济失调等可能与小脑有关,阴极经颅电刺激手段可以通过影响小脑-丘脑-皮质通路的方式影响相关功能,抑制异常步态。此外tES也可辅助特发性震颤及脊髓损伤病人的康复治疗。
· 经颅磁刺激
经颅磁刺激(transcranial magnetic stimulation, TMS)是一种利用时变磁场刺激大脑皮层产生感应电流,改变皮层神经细胞的动作电位,进而影响脑内代谢和神经电活动的物理刺激技术。TMS可检测和调节大脑皮质激活,对中枢神经系统疾病的诊断、评价和监测、干预都有重要意义。重复性磁刺激(repetitive TMS, rTMS)能够改变刺激频率、持续时间和间歇时间等使得大脑产生兴奋或抑制效果,进而改变大脑各皮质区的功能。最新的多靶点TMS能够个性化多区域同时刺激,能进一步提高刺激效果。磁场发生器提供的脉冲形状、振幅等,线圈的结构、方向、位置、电流和频率等都会影响TMS的刺激性能,对刺激线圈、磁场发生器的优化是后续的发展方向[7]。
目前FDA已经批准TMS在抑郁症、偏头痛、强迫症等领域的应用,主要国外厂商包括Magstim、Brainsway等。但在运动障碍等领域仍缺乏循证医学证据。TMS可能诱导癫痫等,其副作用不容忽视,国内NMPA已批准经颅磁刺激产品为二类医疗器械,国内武汉依瑞德等公司是其中代表。
类似于经颅电刺激,经颅磁刺激也可调节突触可塑性。常用的运动区刺激靶点多为位于初级运动区附近的手运动热点(hotspot),但不同皮质区域受损的脑卒中患者靶点并不一致,且治疗效果与刺激靶点的选择密切相关,精准定位靶点可以更有效地缓解症状。在脑卒中运动康复方面,患侧或健侧rTMS可以调节大脑两侧半球的协调竞争机制,联合常规康复训练可辅助康复运动方法。影像导航下进行遥感研究和康复治疗将成为趋势,而直接作用于深层神经核的TMS设备也有较好前景。rTMS调控作用时间约为几分钟,而最新的Theta节律刺激有效调控时间可达30-60分钟。将TMS与外周神经刺激联用构成的成对关联刺激可作为一种有效脑卒中干预手段,其调控效果则取决于刺激间期。
整体而言,目前rTMS在脑卒中运动康复中的应用仍缺乏大型临床试验验证,其神经康复机理仍不明确。且rTMS容易诱发癫痫,相关临床试验需要严格筛选,这也是潜在的问题。研究表明低频和高频rTMS均能改善帕金森导致的运动受损和认知障碍,可能通过调节皮质异常网络模式或正常化皮质的兴奋性来改善肌张力障碍患者症状,但这些研究均缺乏一致性的评估标准。临近疼痛代表区的M1区rTMS刺激能产生更强的止痛作用,影像学引导的定位刺激优化刺激效果的优化,此外运动皮质外的多种相关区域刺激能改善某些特殊类型的疼痛。在脊髓损伤方面,rTMS可通过改善大脑运动皮质兴奋性而促进神经功能恢复,动物研究表明rTMS对运动功能的影响可能与脊髓损伤部位有关[8]。

图3 各中枢调控方法时空分辨率
· 脑深部电刺激
前述两种非侵入式电磁刺激技术刺激效果只局限于皮层,而一些功能网络所涉及到的深部脑区却无法刺激。脑深部电刺激(Deep brain stimulation, DBS)通过在脑内特定的靶点植入刺激电极进行高频电刺激,以达到深部神经刺激,又称脑起搏器。自1987年首次应用于临床以来,因其具有可逆性和可调节性等优势,已发展成为帕金森病及其他运动障碍性疾病的手术治疗康复的主流方式。DBS硬件系统由位于脑刺激区的电极,埋植于体内的脉冲发生器及体外控制器三部分组成。其工作原理是通过植入刺激电极和体内脉冲发生器,由体外控制器调整不同的刺激参数,对脑内特定区域进行一定脉宽、频率、时间的生物电刺激以达到激活或阻断效果。
传统DBS采用原电池供电,使用周期短占用空间大,植入人体后,刺激参数无法改变。基于无线能量和数据传输的深部刺激器正在发展中,无线能量和数据传输的DBS是通过线圈之间的耦合来进行能量和数据传输,可取代传统通过手术更换电池的方式,并延长DBS的使用寿命和降低患者痛苦。近年来出现的方向脑深部电刺激系统,在传统DBS疗法基础上采取更多刺激触点(方向性)电极和刺激程序,旨在寻找到更精准的刺激方法,减少刺激带来的副作用,并节约电能的消耗。
随着靶点定位、电极和脉冲发生器技术的进步以及闭环刺激等更有效的刺激模式的发展,DBS的应用领域不断拓展。闭环电刺激系统能够有效提升系统的可用性,避免持续电刺激造成神经细胞的凋亡和不可逆的伤害[9]。
DBS应用方面,目前FDA已经批准的适应症包括帕金森病、肌张力障碍和原发性震颤,美敦力、雅培、波士顿科学等跨国巨头均有相关产品。治疗原发性震颤已于1997年得到美国FDA批准,特发性震颤的靶点主要选择丘脑腹中间核,丘脑下部区域及丘脑外侧也可能是有效的治疗靶点。DBS可以改善帕金森病患者的震颤、僵直、运动迟缓等运动症状,2002年获FDA批准用于治疗帕金森病,从而提高患者的生命质量,临床上用于帕金森病治疗的靶点主要有丘脑底核和苍白球内侧部。
2020年,FDA批准美敦力公司Percept深部电刺激器用于帕金森治疗康复,其同时具备脑神经信号采集和刺激功能,能够提供更精准的深部电刺激手段。2021年,FDA批注波士顿科学公司MRI兼容深部电刺激系统,同样可提高刺激精准性。大量研究已经证实对全身性以及节段性肌张力障碍有改善作用,尤其对于DYT1肌张力障碍患者。在脑卒中方面,初步研究表明电刺激内囊等结构可影响从主运动区到脊髓运动神经元的通路,进而促进运动康复。而刺激小脑深部结构,也可通过小脑-脑桥-大脑通路等影响运动功能,临床一期实验结果证明了DBS在脑卒中运动康复中的作用[10]。DBS作用于运动障碍疾病的作用机制较为复杂,尚待进一步研究。而目前国内品弛医疗和苏州景昱均有产品获批NMPA三类医疗器械,其中品弛医疗依托清华大学转化成果,在深部电刺激等领域取得了显著成就。
近年出现的经颅时间干涉电刺激(Temporal interference stimulation)可实现非侵入式的深部电刺激,其由两个相差固定频率的高频交流电刺激叠加耦合而成(例如2010和2000Hz),两者的频率差是预估起效的低频电场频率(10Hz)。由于神经元的结构特点,其对高频外加电场的反应微弱,而耦合低频电场包络线可以影响神经元的功能结构,其最大强度出现在脑深部,避免了传统经颅电刺激难以深入大脑和DBS有创的缺点[11]。目前已有一些临床尝试,研究表明70 Hz刺激相对于伪刺激可有效提高随机反应时间和运动皮质的兴奋性,而20Hz能够提高序列反应时间任务中运动学习能力。而多通道的经颅时间干涉电刺激可进一步提升聚焦效率。目前经颅时间干涉电刺激仍作为科研用途,暂时缺乏大规模临床试验支持。
· 硬膜外刺激
DBS的目标刺激部位相对较深,另一种侵入刺激为硬膜外刺激,其目标为相对浅层,可分别作用于大脑皮质和脊髓。对硬膜外皮质刺激,在啮齿动物脑卒中模型中,一二期实验表明患侧刺激能提高运动康复水平,但三期实验中未能取得临床有效性,也有证据表明健侧刺激能够促进运动控制并恢复功能,膜外电刺激治疗的疗效可以维持较长时间。现有研究对刺激的位置、靶点、幅值等尚无没有明确共识,其作用机制尚不明确[12]。
微电极阵列技术的进步有望进一步提高刺激和实时记录的有效性,并促进功能康复。在脊髓损伤方面,研究表明持续的脊髓硬膜外电刺激可初级脊髓损伤大鼠运动功能的恢复,也可使瘫痪患者的下肢独立行走、站立和躯干移动,激活电极的配置和所需的刺激参数可能取决于脊髓解剖结构、损伤严重程度等。而硬膜外电刺激也可调节脊髓网络的兴奋性和功能状态,进而实现上肢功能的改善。现有硬膜外电刺激系统是开环系统,闭环设置可能会增强硬膜外电刺激的效果,目前已在动物实验中得到证实。
瑞士团队证明,硬膜外电刺激可帮助脊髓完全损伤患者恢复运动功能,并在几个月康复训练后,实现瘫痪腿部肌肉的自主控制,这对患者来说是革命性的突破。近期该团队又通过个性化的硬膜外电刺激帮助脊髓损伤患者在一天内恢复基本的迈步功能,其突破性地将脊髓背根作为刺激靶位,间接驱动躯干和下肢的运动功能,并通过闭环调节的方式寻找个性化最佳刺激方式,并让患者迅速实现多种运动功能的替代[13]。但步态的控制仍需结合康复训练逐步完成,且这种刺激方法需要切割脊椎并将装置固定在韧带上,因此这一疗法的风险性不容忽视。
01 外周刺激
人体运动和感觉障碍直接体现在外周神经肌肉等的功能障碍,外周电刺激可直接影响运动功能,并通过神经可塑性促进脑功能重塑。本文主要讨论神经肌肉电刺激、经皮电刺激和迷走神经电刺激等在运动和感觉障碍中的临床应用。
· 神经肌肉电刺激
神经肌肉电刺激(Neuromuscular Electrical Stimulation, NMES)是指利用低频脉冲电流刺激特定神经或肌肉而引起肌肉收缩,以达到改善或恢复被刺激肌肉或肌群自主运动的技术。NMES所刺激的肌肉在解剖上和生理上一般应具备完整的神经支配,只是失去了应有的收缩功能或失去了中枢神经的支配(如脊髓或脑损伤等)。NMES目前已经作为一种常规手段应用于各类运动和感觉障碍的康复干预,已获得多项美国FDA认证,包括表面刺激系统、植入式系统,如用于治疗瘫痪的Parastep、用于上肢康复的FreeHand、用于下肢康复的电刺激单车Restorative Therapies RT300、WalkAide等。
国内也有不少神经肌肉功能电刺激产品获批二类证上市,但现有产品更多是表面电刺激。而国外还有包括CE认证的STIMuSTEP和Ottobock公司的ActiGait神经假体等植入式刺激系统。上世纪80年代以来,NMES研究在电极及其使用方式、刺激系统、控制模式等方面取得了重大的发展。近年来,电刺激系统从分立器件发展到CMOS专用集成电路、带微处理器的专用集成电路等,再到近期伴随微电子技术和微纳技术发展起来的基于芯片系统(SOC)的神经电刺激器系统,小型化、低功耗、高性能、智能化等是未来发展方向。
电极方面,从早期的单通道刺激电极,到后期采用的多通道系统,再到近期的表面阵列电极、柔性织物电极,以及可实现手部精确运动控制的高密度柔性阵列系统,朝着便携式、高精度、高集成度、柔性可穿戴方向发展。
电源供电方面,除了电池供电和交流电源供电等传统手段,体外经皮无线供能的方式逐步成为突破瓶颈的重要方向,如通过磁耦合方式完成近场体外供电。近年来基于自供电式摩擦电纳米发电机的NMES系统,已经开始用于肌肉的功能康复,与传统的电刺激相比,该系统能实现长期稳定的神经肌肉电刺激[14]。
NMES控制模式方面,早期的NMES设备只能提供单向的被动刺激,根据预设的刺激参数完成康复治疗,缺乏患者的主动反馈,限制了康复应用。后续利用表面肌电提供生物反馈信号,发现肌电触发的NMES可显著促进脑卒中患者的上肢运动功能康复。后续研究将肌电检测与电刺激输出实时同步进行,病人可自主控制刺激强度,构成完整闭环反馈控制回路。而基于非侵入式运动想象脑机接口(BCI)系统的FES控制系统,也逐步发展并应用于脑卒中运动康复中,能够有效提升患者运动机能。
2016年美国范斯坦纪念研究所和俄亥俄州立大学的研究团队,在一位四肢瘫痪的脊髓损伤病人脑中植入Utah微电极,通过解码皮层神经活动控制高分辨率的柔性高密度NMES设备,可完成抓握、转腕、搅拌等上肢动作,甚至能完成简单游戏,如图4所示。近期该团队又进一步基于侵入式脑机接口和多通道NMES阵列实现了患者运动及触觉功能的恢复[15]。

图4 柔性高密度NMES和侵入式BCI-NMES系统
· 经皮电刺激
早在上世纪七十年代,经皮电刺激技术(Transcutaneous electrical nerve stimulation, TENS)已经广泛应用于镇痛,并获得FDA认证。此外,TENS可有效提高慢性期脑卒中瘫痪病人的感觉运动功能恢复。研究表明,通过刺激外周神经,可以产生沿着神经传导到相应的皮质区,并激活大脑功能。但刺激强度尚无共识,这表明需要更多临床试验来进行验证,仍然需要寻找最优的刺激参数设置。经皮电刺激作用于感觉运动康复的理论基础也并不完善,有研究表明,TENS诱发的感觉输入可以引起脑卒中损伤处的皮质神经功能重组,某些运动神经元功能和脑功能网络也有相应变化,但目前仍缺乏更详细的解释,且缺乏更多临床试验证据。此外,TENS还尝试用于脑瘫痉挛、脊髓损伤引起疼痛等的治疗康复等,但目前应用仍较为有限[16]。
· 迷走神经电刺激
迷走神经刺激术(Vagus Nerve Stimulation,VNS)是一种通过刺激迷走神经治疗相应疾病的治疗康复手段。目前迷走神经电刺激在运动康复的应用仍在初级阶段,以动物实验为主,部分开展人体临床试验。VNS可缓解缺血性脑卒中供血不足,抑制肿瘤坏死因子和白细胞介素等炎症细胞因子的释放而产生抗炎作用,从而减轻脑卒中病灶周围的炎症反应,参与调控急性期、亚急性期缺血性脑卒中感觉运动康复。缺血性大鼠模型和人体临床试验表明侵入式VNS结合传统康复训练相对伪刺激对照组有更好的临床康复效果。
2021年,MicroTransponder设计开发的侵入式迷走神经刺激器Vivistim,获得FDA批准用于缺血性中风康复[17]。类似的,非侵入式颈部VNS也可降低梗塞体积,并能够提高脑卒中大鼠模型感觉运动康复的有效性,在人体康复应用仍较为有限。对于脊髓损伤,目前已有大鼠实验证明闭环VNS结合康复训练可有效提升前臂力量,但仍缺乏人体临床试验。
#3、超声及光刺激
不同于电磁刺激,超声刺激及光刺激的临床应用目前仍在初级发展阶段,但光声刺激在神经调控领域独具优势并有广泛应用前景。
01 超声刺激
超声波指频率高于20 kHz的声波,长期应用于临床影像学检查以及物理治疗等目的。二十世纪三十年代,Harvey发现超声可以激活坐骨神经并引发腓肠肌颤动,超声的神经调控作用开始逐渐获得更多关注。高强度聚焦超声(focused ultrasound, FUS)的热效应易引起细胞的不可逆损伤甚至死亡,主要用于热消融,可应用于各类运动障碍疾病(原发性震颤、帕金森病),但常引起面部或躯体感觉异常和步态不稳等副反应,2016年FDA已批准基于MRI引导的聚焦超声设备用于治疗原发性震颤,2018年批准了Insightec公司FUS产品用于治疗帕金森病。而无热效应的低强度聚焦超声刺激(LIFUS)可利用超声机械作用即辐射力对生物组织产生机械作用并发生位移,进而激活细胞膜磷脂双分子层中的机械敏感性离子通道,使神经元表现出兴奋状态,一般LIFUS强度均小于FDA批准用于超声成像的强度,具有较好的安全性。
LIFUS在神经调控的作用可分为中枢和外周神经调控,如图5所示。经颅聚焦超声刺激(transcranial focused ultrasound stimulation,tFUS)可产生类似DBS的效果,但tFUS是无创的,其中枢神经调控效果与刺激强度密切相关。刺激人类初级运动皮层,可导致运动诱发电位的波幅减小,也激活初级运动皮层。由于聚焦超声刺激需要穿过颅骨,不可避免存在大幅衰减,通过相控阵技术可实现声束几何学及方向的人为控制。
超声波结合神经功能影像学及脑电活动记录为精确掌握神经网络活动提供了技术和理论证明,也为探索正常人脑功能提供了新工具。tFUS相对于其他物理刺激干预技术,具有穿透深度大、靶点控制便捷、无创以及可图像引导等优点。超声刺激参数如中心频率、能量强度、脉冲变化规律、能量传导方式以及照射靶点区域的大小均可被灵活调节。早期的超声神经调控实验装置由体积庞大的分立仪器搭建而成,例如采用函数信号发生器、射频功率放大器和常规尺寸的超声换能器搭建单振元超声刺激平台[18]。
中科院深圳先进技术研究院郑海荣研究员团队研制了便携式超声脑刺激系统、声表面波操控系统和阵列式超声脑刺激系统。基于磁共振成像技术,实现了对实验对象的解剖结构成像、位移场检测、温度监测和脑功能成像等功能,可原位评估超声神经调控的作用效果及安全性,可实现图像引导的超声神经刺激应用。tFUS对脑卒中拥有一定的神经调节和保护作用,可调节周围神经、海马结构、大脑皮层、脊髓及外周躯体感觉神经功能[19]。此外,tFUS能暂时性干扰血脑屏障以利于靶向药物到达脑内,联合微泡载药技术可暂时性提高血脑屏障通透性,利于脑源性神经营养因子通过血脑屏障到达脑组织改善脑神经症状。
目前推荐临床治疗的超声中心频率为0.75~3.00MHz,平均声强不得超过3W/cm2,需注意频率不能过大,否则会造成组织损伤。研究证实超声刺激具有增强及抑制神经活动的双重作用,经颅超声刺激信号的频率、强度、作用时间、调制方式不同均会引起作用效果的不同。目前治疗脑神经相关疾病的临床试验较少,明确的刺激参数和安全阈值还需要长期深入研究,目前尚无FDA认证。

图5 经颅及外周聚焦超声刺激
一般而言,有效外周聚焦超声刺激的强度要高于中枢超声刺激。特定强度的LIFUS可使离体蟾蜍的坐骨神经电活动增强,而较高强度则会出现可逆性的抑制作用。LIFUS可抑制迷走神经,导致相应的复合动作电位波幅降低,潜伏期延长。2019年,GE公司利用外周聚焦超声刺激人体肝脏、脾脏附近迷走神经来调控血糖、炎症等,用于调节人体代谢、心血管、炎症控制系统中的功能障碍,开辟了新的应用场景,目前仍在临床试验过程中。
哥伦比亚大学团队搭建了外周聚焦超声刺激(pFUS)系统,初步探讨了在离体、在体动物神经组织、健康人的低强度外周超声刺激系统,并应用于疼痛治疗等领域,用于调节运动与感觉相关神经,但目前在临床康复方面的应用仍有限。研究表明,pFUS还可引起坐骨神经神经轴突反射,可诱发远端血流灌注,并具有较高特异性和应用潜力。
目前这些研究都处在初级阶段,不同刺激参数如何影响仍需更多临床试验证明,外周聚焦超声刺激调控神经肌肉功能重建与康复的机制仍不明确[20]。类似于tFUS,采用影像引导的外周聚焦超声刺激能够提高刺激的有效率, MRI、超声、激光多普勒等能辅助引导定位,防止脱靶误伤,刺激监测一体化的便携式设备是未来的发展方向。
02 光刺激
光刺激因其方向性好和空间分辨率高等优势,备受神经调控研究领域关注。目前光调控的研究中选用的光波长范围包括可见光到红外光等,如图6所示,不同波长的光诱发神经响应的作用机制不同。其中光遗传技术是最常见的一种光神经调控技术,利用基因修饰的手段将光敏感因子转染到特定类型的神经元或将光敏感分子结合特定离子通道,然后通过可见光照射光敏感因子来控制细胞膜离子通道的开放或关闭,从而实现对神经元或细胞的激活或抑制。虽然光基因技术在神经系统上的应用已经非常广泛,但需要通过基因修饰或引入外源性因子等操作才能够实现,其安全性一直受到关注。红外神经刺激(Infrared neural stimulation)将近红外光(常用波长:1.2-2.2微米)直接作用于神经组织,利用光热作用从而激活或抑制神经元上动作电位的发放,进而调节脑的功能。其方向性好、空间分辨率高等优势,有望作为一种新的中枢神经调控技术用于神经功能网络研究或脑疾病调控等,但目前机制仍不明确。
现有近红外调控中枢神经系统的研究都是有创调控,刺激时需暴露皮层组织,限制了其临床应用。后续研究可选择合适更高穿透系数的近红外光、设计多阵列聚焦光源等手段,使得近红外光穿透头皮及颅骨后能有更多的能量聚焦在脑组织指定区域,实现低创、无创刺激[21]。
此外,最新发展的中红外光刺激(Midinfrared Stimulation,MIRS)能够作为一种新型的神经调控策略,发现5.6微米波长的MIRS能够以非热的方式调节神经元的信号发生、动作电位波形以及动物行为,并且这种调控作用具有非热、可逆、长距离的特点。中红外刺激调节生物大分子内部化学键的振动频率形成共振则可能调控通道的功能,从而影响神经元的电活动。MIRS可作为一种新型的神经调控手段,以无创、非热、可逆的方式调节神经活动和行为,在脑功能调控和脑疾病治疗等方面有潜在临床应用价值,但红外光刺激对神经活动的影响仍需进一步深入研究[22]。
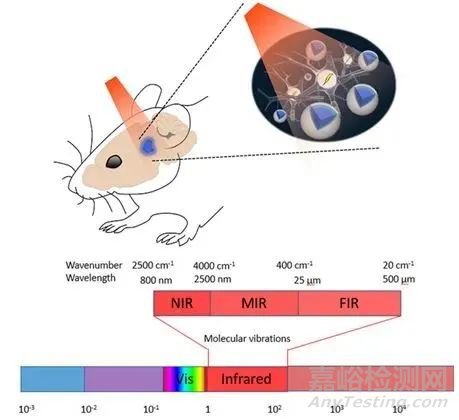
图6 新型光刺激及其波长等
#4、总结与展望
基于各种物理因子的神经刺激调控技术辅助运动和感觉康复已成为国际学术和应用研究的前沿和热点方向,物理因子干预技术通过刺激调控中枢和外周神经系统,其本质是促进替代、增强、重塑运动和感觉系统功能。但现有电磁光声等物理因子干预技术的作用机制仍不明确,电磁干预技术相对成熟,而光声刺激等领域仍在初步发展阶段。即使是电磁干预技术,其理论基础并不深入、最优干预参数等并不明确,非侵入式系统受限于调控的精度,而侵入式系统则有手术风险。物理因子干预技术需要平衡刺激靶点的特异性、侵入性和患者可接受性,并根据不同患者需求定制个性化康复干预方案,也需要临床医生与多学科研究人员的密切合作。
在神经科学方兴未艾的当下,对于人体感觉运动控制系统运行机制的深入理解必将进一步提高对运动和感觉障碍的机制,以给出更加精准有效的物理干预模式。联合应用多种神经影像学及电生理方法,采取影像引导和电生理标定等技术,能够进行更为精准的损伤定位和功能检测,有助于制定更为有效的康复干预方案。物理因子干预技术与脑机接口、康复机器人、虚拟现实、增强现实等技术的结合也将进一步丰富其应用场景,并提升系统有效性。近年来技术的进步如新材料、电池及自供能技术、封装等加工工艺、高密度电极阵列、微创刺激技术、柔性电子、可穿戴技术、闭环反馈刺激调控、远程监护技术等都将进一步提高物理因子康复干预技术的临床应用。而新型电磁光声神经刺激调控技术的发展也将不断拓展应用范围,并引领行业基础研究和制造技术的发展。
参考文献
[1] S.-C. Bao, C. Chen, K. Yuan, Y. Yang, and R. Kai-Yu Tong, “Disrupted cortico-peripheral interactions in motor disorders,” Clinical Neurophysiology, vol. 132, no. 12, pp. 3136–3151, Oct. 2021, doi: 10.1016/j.clinph.2021.09.015.
[2] E. Krames, P. H. Peckham, and A. R. Rezai, Eds., Neuromodulation: Comprehensive Textbook of Principles, Technologies, and Therapies, 2nd edition. London, United Kingdom: Academic Press, 2018.
[3] S. Bao, A. Khan, R. Song, and R. Kai-yu Tong, “Rewiring the Lesioned Brain: Electrical Stimulation for Post-Stroke Motor Restoration,” Journal of Stroke, vol. 22, no. 1, pp. 47–63, Jan. 2020, doi: 10.5853/jos.2019.03027.
[4] M. Bikson et al., “Transcranial electrical stimulation nomenclature,” Brain Stimulation, Jul. 2019, doi: 10.1016/j.brs.2019.07.010.

来源:BME康复工程分会


