2023年3月2日,FDA药品审评和研究中心发布了《Artificial Intelligence in Drug Manufacturing》讨论文件,供公众在2023年5月1日前提出意见。
人工智能是FRAME优先考虑的四种技术之一
先进的生产技术有可能提高生产过程和供应链的可靠性和稳健性,并增加美国公众及时获得优质药品的机会。药品审评和研究中心(CDER)建立了先进生产评估监管框架(Regulatory Advanced Manufacturing Evaluation,FRAME)计划,以支持采用可以为患者带来益处的先进生产技术。
美国国家科学院、工程院和医学院(NASEM)发布了一份报告,确定CDER可能遇到的具有推进制药生产潜力的创新。根据这份报告以及通过新兴技术计划与利益相关者的接触,FRAME计划优先考虑四种技术:
端到端连续生产(End-to-End Continuous Manufacturing,E2E CM):一个完全集成的过程,原材料不断被输入和转化,药品成品不断被生产出来。
分布式生产(Distributed Manufacturing,DM):一个分散的生产平台,其生产单元可以部署到多个位置。
即时护理生产(Point-of-Care Manufacturing,POC):一个DM平台,其生产单元靠近患者护理,例如,在医疗机构。
人工智能:可以感知环境、解释数据和决定行动的软件和硬件系统。
以下是讨论稿全文内容。
1、简介
药品审评和研究中心(CDER)的使命是确保人类药物的安全和有效,符合既定的质量标准,并提供给患者。为了推进这一使命,FDA的"Pharmaceutical Quality for the 21st Century(21世纪药品质量计划)"促进了一个高效、敏捷和灵活的药品生产部门,在没有过度监管的情况下可靠地生产优质药品。
药物开发的趋势凸显了对生产过程中更多灵活性的需求。
先进生产(Advanced manufacturing)是一个术语,它描述了一种创新的药品生产技术或方法,有可能提高生产过程的可靠性和稳健性以及供应链的弹性。先进生产可以:(a)整合新的技术方法,(b)以创新的方式使用已有的技术,或(c)在没有确定的最佳实践的新领域中应用生产方法。先进生产可用于新的或目前上市的大分子或小分子药物。
FDA已经认识到并接受了先进生产的潜力。2014年,CDER建立了新兴技术项目(Emerging Technology Program,ETP),与企业合作,支持先进生产的使用。CDER通过ETP观察到先进生产技术的快速出现,并认识到监管政策和计划可能需要演变,让技术得到及时采用。
美国国家科学、工程和医学研究院在2021年发布了一份报告,题目是Innovation in Pharmaceutical Manufacturing on the Horizon: Technical Challenge, Regulatory Issues, and Recommendations(地平线上的药品生产创新:技术挑战、监管问题和建议) ,强调了综合药品生产过程中的创新。这些创新可能会对制药生产中使用的测量、建模和控制技术产生影响。人工智能(AI)可能在监测和控制先进的生产过程中发挥重要作用。
2、范围
当FDA考虑将其基于风险的监管框架应用于药品生产中的人工智能技术时,该机构在本讨论文件中确定了公众反馈将是有价值的领域。CDER的科学和政策专家通过对适用于批准使用人工智能技术生产的药物的现有监管要求进行全面分析,确定了这些领域。
本讨论文件中的考虑领域是FDA希望得到公众反馈的领域。还有一些考虑的领域没有包括在本文件中,例如,在如何将现有的《现行药品生产质量管理规范》(CGMP)法规应用于人工智能方面可能存在的模糊性,或缺乏机构的指导或经验,都可能导致困难。本讨论文件中提出的考虑领域集中在根据新药申请(NDA)、简略新药申请(ANDA)或生物制剂许可申请(BLA)上市的药物产品的生产。
公众反馈将有助于CDER对我们现有的监管框架进行评估。虽然最初的分析侧重于由CDER监管的产品,但FDA的生物制品评估和研究中心(CBER)也遇到了与人工智能相关的先进生产技术的快速出现。因此,我们邀请CDER和CBER的利益相关者对讨论问题提供反馈。
3、背景介绍
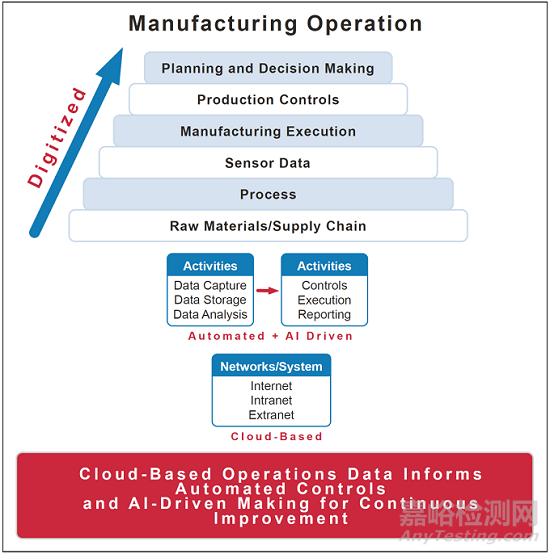
人工智能为制药业提供了许多可能性,包括但不限于优化工艺设计和工艺控制,智能监测和维护,以及趋势监测以推动持续改进。使用人工智能来支持药品生产,可以与其他先进的生产技术一起部署,以实现预期的效益。人工智能是实施工业4.0模式的助推器,可以为生产商带来一个控制良好、超级连接、数字化的生态系统和医药价值链。
通过与行业的互动,FDA收到了宝贵的反馈,包括潜在的人工智能在药品生产中的使用案例。以下是基于这些互动和对已发表信息的审查,预测人工智能如何用于制药业的例子。这些例子并不详尽,人工智能在制药业的潜在应用可能会继续发展。
工艺设计和放大。可以利用机器学习等人工智能模型--使用工艺开发数据生成--更快速地确定最佳加工参数或放大工艺,减少开发时间和浪费。
先进工艺控制(APC)。APC允许对生产过程进行动态控制,以达到理想的产出。人工智能方法也可用于开发过程控制,通过使用人工智能与实时传感器数据相结合,可以预测过程的进展情况。将对生产过程中发生的基本化学、物理和生物转化的理解与人工智能技术相结合的APC方法预计将看到越来越多的采用,并且已经被一些制药公司报告。
过程监控和故障检测。人工智能方法可用于监测设备,并检测出与正常性能不同的变化,从而触发维护活动,减少工艺停工时间。人工智能方法也可用于监测产品质量,包括包装质量(例如,基于视觉的质量控制,使用包装、标签或玻璃瓶的图像,由基于人工智能的软件进行分析,以检测产品的特定质量属性要求的偏差)。
趋势监测。人工智能可用于检查消费者投诉和包含大量文本的偏差报告,以确定集中问题领域并优先考虑持续改进的领域。这提供了识别生产相关偏差的趋势的优势,以支持更全面的根源识别。与工艺性能和工艺能力指标相结合的人工智能方法可用于主动监测生产业务的趋势。这些方法还可以预测触发纠正和预防行动有效性评估的阈值。
4、术语
以下定义仅用于本讨论文件的目的。
人工智能(AI)。计算机科学、统计学和工程学的一个分支,使用表现出学习、决策和预测等行为的算法或模型。
机器学习(ML)。人工智能的一个分支,为系统提供通过分析数据开发模型的能力,而不需要明确的编程,并根据数据或经验加以改进。
模型(Model)。对一个物理系统的抽象描述,以任何形式(包括数学、符号、图形或描述性)表示该物理系统的某个方面。
云计算(Cloud Computing)。一种模式,用于实现无处不在的、方便的、按需的网络访问,共享可配置的计算资源(例如,网络、服务器、存储、应用、服务),可以快速配置和释放,只需最小的管理努力或服务提供商的互动。
元数据(Metadata)。了解数据所需的背景信息。
边缘计算(Edge Computing)。在特定数据源处或附近完成的分布式计算形式。
数据管理(Data Management)。收集、存储、组织、维护和保护一个组织所创建的数据的过程。
物联网(IOT):一种网络物理系统,包括相互连接的计算设备、传感器、仪器和设备,在线整合成一个有凝聚力的设备网络,其中包含硬件、软件、固件和执行器,使设备能够连接、互动并交换数据和信息。物联网设备包括传感器、控制器和机械设备。
5、与人工智能相关的考虑领域
1)云应用可能会影响对药品生产数据和记录的监督
随着云计算和边缘计算的不断发展,涉及药品生产的软件的部署位置可能发生变化。例如,控制执行的软件可能仍然在靠近生产设备的地方部署,以确保不影响性能或安全,而其他不是时间关键的软件功能可以在云中进行(例如,模型更新、控制诊断和过程监控分析)。第三方数据管理系统可用于数据存储之外的功能。例如,存储在这些系统中的数据可以由人工智能进行分析,以支持过程监测和APC的模型。
在这些环境中必须确保数据的完整性和数据质量。虽然FDA允许在生产商的适当监督下使用第三方的CGMP功能,但生产商和第三方之间现有的质量协议(例如,云数据管理)在管理生产监测和控制方面的人工智能风险方面可能存在差距。在检查过程中,这可能导致在确保第三方创建和更新人工智能软件时有适当的数据安全和保障措施方面的挑战。
此外,由于管理第三方云数据和模型的复杂性,FDA对记录管理的证据收集的检查方法可能需要扩大。例如,云应用程序和流程控制之间的持续互动可能会使建立数据可追溯性的能力复杂化,产生潜在的网络安全漏洞,并需要在检查期间评估监测数据完整性漏洞的现有程序。
一些潜在的相关要求和政策
Regulations:
21 CFR 11, 211.180, 211.184, 211.194, 600.12
Draft Guidance for Industry:
Data Integrity and Compliance with CGMP (April 2016)
Guidance for Industry:
Contract Manufacturing Arrangements for Drugs: Quality Agreements (November 2016)
ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients (September 2016)
2)物联网可能会增加药品生产过程中产生的数据量,影响现有的数据管理实践
生产控制的数字化可能会产生更多关于工艺和产品的信息。数据的增加可能体现在记录数据的频率和类型两方面。有法规和指南涉及每批药品生产的数据和元数据的存储量;但是,如果生产过程中收集的原始数据显著增加,可能需要结合数据管理组织工作,平衡数据的完整性和保留。
申请人可能需要明确生成数据的监管合规性(例如,哪些数据需要存储和/或审查,以及这些数据的丢失将如何影响未来的质量决策,如产品召回)。此外,申请人可能需要进一步明确数据采样率、数据压缩或其他数据管理方法,以确保保持药品生产过程的准确记录。
另外,在以结构化的方式存储数据,以便检索和分析以支持申请人的决策方面可能存在挑战。此外,随着生产设备互联成网,维护设备所产生的这些数据的管理、隐私和安全,可能对保持产品质量或维持药品生产构成挑战。
一些潜在的相关要求和政策
Regulations:
21 CFR 211 Subparts D and J
Draft Guidance for Industry:
Data Integrity and Compliance with CGMP (April 2016)
Guidance for Industry:
ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients (September 2016)
3)申请人可能需要明确人工智能在药品生产中的应用是否以及如何受到监管部门的监督
人工智能可用于各种生产操作,如监测和维护设备,确定需要持续改进的领域,调度和供应链物流,以及原材料的特性。申请人需要了解人工智能在受监管部门监督的生产业务中的应用(例如,CGMP合规性、新药或生物制品许可证申请)。
一些潜在的相关要求和政策
Regulations:
21 CFR 11, 211.68, 211.84, 211.180, 211.184, 314.50, 314.94, 601.20
Draft Guidance for Industry:
ICH Q9(R1) Quality Risk Management (June 2022)
ICH Q12 Implementation Considerations for FDA-Regulated Products (May 2021)
Data Integrity and Compliance with CGMP (April 2016)
Guidance for Industry:
ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients (September 2016)
ICH Q8(R2) Pharmaceutical Development (November 2009)
ICH Q10 Pharmaceutical Quality System (April 2009)
ICH Q11 Development and Manufacture of Drug Substances (November 2012)
ICH Q12 Technical and Regulatory Considerations for Pharmaceutical Product Lifecycle Management (May 2021)
Q8, Q9, & Q10 Questions and Answers — Appendix: Q&As from Training Sessions (July 2012)
Process Validation: General Principles and Practices (January 2011)
Compliance Program:
7346.832 — Preapproval Inspections (October 2022)
7356.002 — Drug Manufacturing Inspections (October 2022)
7356.002M — Surveillance Inspections of Protein Drug Substance Manufacturers (October 2021)
4)申请人可能需要开发和验证用于过程控制和支持释放测试的AI模型的标准
人工智能可用于APC应用中,通过基于实时数据调整工艺参数来控制生产过程。此外,人工智能模型可以与过程中的材料或最终产品的审查结合起来使用,以:(1)支持过程中或最终产品测试的分析程序,(2)支持实时释放测试,或(3)预测过程中产品质量属性。在开发和验证影响产品质量的模型方面,可用的行业标准和FDA指南有限,这可能对建立特定用途的模型的可信度造成挑战。
基础数据的稳健性决定了人工智能模型的决策。这可能会在避免模型开发和验证过程中出现意外的偏见方面带来挑战。人工智能模型也可以存储在为特定用例开发过程中获得的知识,然后将其应用于不同但相关的用例,以加速模型的开发。申请人和生产商可能需要明确如何在模型开发和验证中考虑将学习从一个人工智能模型转移到另一个模型的可能性。
随着人工智能方法变得越来越复杂,解释模型输入的变化如何影响模型的输出变得越来越有挑战性。在这些情况下,申请人可能面临的挑战是如何定义验证模型的标准,并维持模型输出的可解释性和对产品质量的影响。
一些潜在的相关要求和政策
Regulations:
21 CFR 11, 211.68, 211.110, 211.165, 211.180
Draft Guidance for Industry:
ICH Q14 Analytical Procedure Development (August 2022)
Guidance for Industry:
ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients (September 2016)
ICH Q8(R2) Pharmaceutical Development (November 2009)
ICH Q9 Quality Risk Management (June 2006)
ICH Q10 Pharmaceutical Quality System (April 2009)
ICH Q11 Development and Manufacture of Drug Substances (November 2012)
Process Validation: General Principles and Practices (January 2011)
Development and Submission of Near Infrared Analytical Procedures (August 2021)
Compliance Program:
7346.832 — Preapproval Inspections (October 2022)
7356.002 — Drug Manufacturing Inspections (October 2022)
7356.002M — Surveillance inspections of Protein Drug Substance Manufacturers (October 2021)
5)不断学习适应实时数据的人工智能系统可能对监管评估和监督提出挑战
在目前的范式中,部署在生产中的模型(如过程中的控制、实时释放测试)是通过制药质量体系内的变更控制过程,根据需要进行开发、验证、实施和更新。人工智能模型(例如,基于机器学习的模型)可以持续学习,其中模型随着新信息的出现而不断发展。
要确定人工智能模型何时可被视为一个过程的既定条件,这可能是一个挑战。作为产品生命周期中模型维护的一部分,确定对模型变化的监管标准也可能是一个挑战。申请人可能需要明确:(a)对模型生命周期战略的验证的期望,以及FDA在现场检查期间对不断更新的人工智能控制模型的检查方法,以及(b)在人工智能模型引入生产条件的变化后建立产品可比性的期望,特别是对生物产品。
一些潜在的相关要求和政策
Regulations:
21 CFR 11, 211.68, 211.180, 314.70, 314.97, 601.12
Draft Guidance for Industry:
ICH Q12 Implementation Considerations for FDA-Regulated Products (May 2021)
Guidance for Industry:
ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients (September 2016)
Q8, Q9, & Q10 Questions and Answers — Appendix: Q&As from Training Sessions (July 2012)
ICH Q12 Technical and Regulatory Considerations for Pharmaceutical Product Lifecycle Management (May 2021)
Development and Submission of Near Infrared Analytical Procedures (August 2021)
Changes to an Approved NDA or ANDA (April 2004)
Changes to an Approved Application for Specified Biotechnology and Specified Synthetic Biological Products (July 1997)
SUPAC-MR: Modified Release Solid Oral Dosage Forms Scale-Up and Post-Approval Changes: Chemistry, Manufacturing, and Controls; In Vitro Dissolution Testing and In Vivo Bioequivalence Documentation: Guidance for Industry (October 1997)
SUPAC-IR: Immediate-Release Solid Oral Dosage Forms: Scale-Up and Post-Approval Changes: Chemistry, Manufacturing and Controls, In Vitro Dissolution Testing, and In Vivo Bioequivalence Documentation (November 1995)
6、AI问题和反馈部分
1)你设想哪些类型的人工智能应用会被用于药品生产?
2)目前的监管框架是否有其他方面(例如,上面没有列出的方面)可能会影响人工智能在药品生产中的实施,并应由FDA考虑?
3)药品生产中的人工智能领域的指导是否有益?如果是这样,应考虑人工智能技术的哪些方面?
4)生产商在CGMP环境中实施基于人工智能的模型的必要因素是什么?
5)验证和维护自学人工智能模型的常见做法是什么,需要考虑哪些步骤来建立最佳做法?
6)在药品生产中,管理用于生成人工智能模型的数据的必要机制是什么?
7)在为制药业实施模型(包括基于人工智能的模型)的过程中,是否有其他方面需要进一步指导?
8)本文件中未涉及的人工智能在药品生产中的应用,是否有FDA应该考虑的方面?
7、总结
本讨论文件提出了需要考虑的领域和潜在的政策发展。
CDER 在评估现有监管框架在药品生产中应用人工智能的基础上,确定了需要考虑的领域和潜在的政策发展。先进生产评估的监管框架将解决这些领域的问题,同时也考虑潜在的变化会如何影响现有的技术和设施。CDER将利用提交给备查文件的反馈意见为未来的政策制定提供参考。请将您对本讨论文件的意见提交至 https:// www.regulations.gov,备查文件号:FDA-2023-N-0487。
8、附录
附录A:相关指南、政策和法规

附录B:人工智能技术概述
附录C:首字母缩写词和缩略语
参考资料
https://www.fda.gov/about-fda/center-drug-evaluation-and-research-cder/cders-framework-regulatory-advanced-manufacturing-evaluation-frame-initiative
https://www.fda.gov/media/165743/download