2023年4月3日,迈心诺医疗(Masimo,纳斯达克股票代码:MASI)宣布其 Masimo Opioid Halo 获得了FDA的De Novo授权。该产品是业内第一个通过 FDA 批准的阿片剂量监测系统,主要用于检测阿片类药物引起的呼吸抑制。
迈心诺医疗在新闻稿中表示,本次FDA授权帮助公司在与同行进行阿片类药物创新竞争中取得明显优势。早在2018年,FDA就已经批准迈心诺医疗开发一种有助于防止阿片类药物过量的设备,随后其它公司也加入了这张药物研发竞赛中。
公司创始人兼首席执行官Joe Kiani称阿片类药物危机“对年轻人的影响具有相当程度的破坏性”,以至于降低了美国人的整体预期寿命。他表示,公司“非常高兴”能够提供一种新的解决方案来应对阿片类药物危机。
Kiani说:“现在,借助我们所开发的产品Opioid Halo,我们希望做出重大改变来帮助数百万的患者,无论他们是服用正规的处方类阿片类药物,还是非法使用非处方类阿片类药物。我们感谢FDA应对阿片类药物流行病并批准这一新药——这是在防止阿片过量服用导致死亡,并结束阿片类药物危机方面迈出的一大步。”
一、产品和授权的更多信息
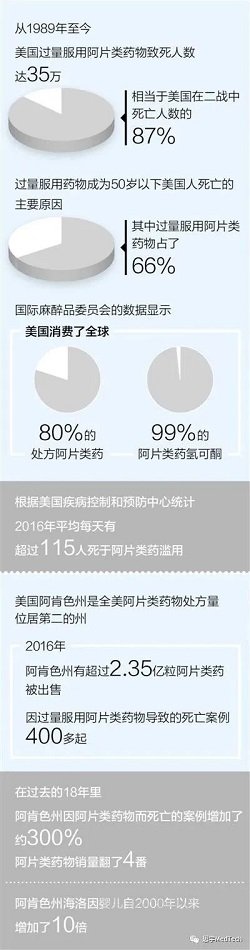
阿片类药物是从阿片(罂粟)中提取的生物碱及衍生物,能缓解疼痛,但长期服用可上瘾。在美国,阿片类药物上瘾和滥用已演变成“最严重的公共卫生危机”,甚至有媒体称其为美国“历史上最致命的毒品流行”。
▲人民日报2018年文章
《美国“阿片危机”暴露社会痼疾》配图
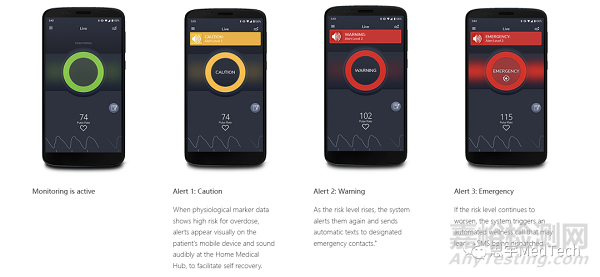
迈心诺医疗所开发的Masimo Opioid Halo使用先进的模式识别算法来实时检测和量化阿片类药物引起的呼吸抑制的风险。它与分布式架构相结合,可以发送警报给患者及其家人、朋友和护理人员。当Opioid Halo认定患者已经服用过量阿片类药物且可能需要帮助时,将自动触发可能导致派遣EMS(Emergency Medical Services,紧急医疗服务)的自动健康呼叫。
▲Masimo Opioid Halo的分级警告系统
Masimo Opioid Halo系统由Masimo SET脉搏血氧仪提供支持,该血氧仪已经取得美国10大医院之中9家的信任。Opioid Halo主要由手机App、报警蜂鸣器以及手部传感器三部分组成,系统将根据监测数据和患者的操作情况来自动判定需要采取哪些措施。
▲Masimo Opioid Halo监测系统的手部传感器
FDA的De Novo授权允许Opioid Halo的非处方药可用性。成人和15岁及以上的儿童无需处方即可购买。医疗保健提供者还可以为患者批准Rx版本供处方使用。
De novo流程建立在FDAMA法案(《1997年食品药品管理局现代化法》)下适用于没有前代产品的器械分类,在优化审评流程质量的同时能够有效扶持创新型产品。
通过审评相关证据,FDA如发现该医疗器械的风险通过常规或特殊控制措施即可保证医疗器械的安全有效性,则该医疗器械可被分类为I类或者II类。任何通过该种途径被分到I类或者II类的产品都可在将来的510(k)申请中视为同品种产品。因此,De Novo可以被视为510(k)的铺垫。
二、关于迈心诺医疗
迈心诺医疗(全称Masimo Corporation)是一家全球医疗技术公司,它开发、制造和销售各种无创的患者监测技术、医院自动化解决方案、家庭监控设备等消费产品。公司总部位于加利福尼亚州。
公司的核心产品是脉搏血氧仪,同时公司还精通于高级脉搏共脉冲测量(Masimo Signal Extraction Technology (SET)),大脑功能监测,区域血氧仪,声学呼吸速率监测,鼻腔高流量呼吸支持治疗等技术。
该公司于2007年上市。2011年,福布斯(Forbes)曾将迈心诺医疗提名为十亿美元收入级别的前20名上市公司。
就在不久之前的3月23日,公司宣布对其董事会和治理政策进行了一系列调整,内容包括首席独立董事任命、高管薪酬变动等。