您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-04-10 14:46
近日,江苏先声医疗器械有限公司研发的“人CYP2C19基因分型检测试剂盒(飞行时间质谱法) ”获批上市,下面嘉峪检测网与您一起了解一下人CYP2C19基因分型检测试剂盒(飞行时间质谱法)在临床前研发阶段做了哪些实验。
1、人CYP2C19基因分型检测试剂盒(飞行时间质谱法)的主要组成成分
产品主要组成成分见下表
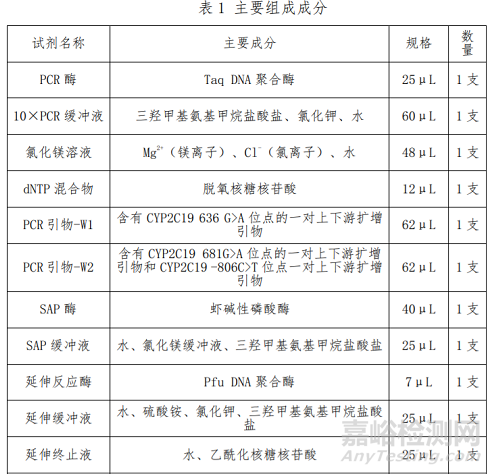
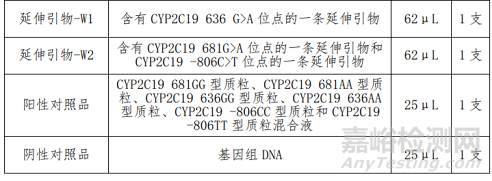

2、人CYP2C19基因分型检测试剂盒(飞行时间质谱法)的预期用途
本产品用于体外定性检测人外周血样本中的CYP2C19基因681位点 G>A、636 位点 G>A 和-806 位点 C>T 的多态性。 本产品用于氯吡格雷的用药指导。本产品不能预测患者 对氯吡格雷的应答情况,仅能辅助医生确定氯吡格雷治疗策略。本产品检测结果仅供临床参考,不应作为患者是否用药 的唯一依据,临床医生应结合患者病情、疗效及其他实验室检测指标等对本产品的检测结果进行综合判断。
3、人CYP2C19基因分型检测试剂盒(飞行时间质谱法)的检验原理
本试剂盒采用了多重PCR扩增技术、单碱基延伸技术 及飞行时间质谱检测技术。根据所选择的多态性位点设计多重PCR特异性扩增引物和延伸引物,PCR 扩增包含多态性 位点的基因序列,特异延伸引物在SNP位点上延伸1个碱基, 单碱基延伸产物经特定处理后与芯片基质共结晶,瞬时(10-9s) 强激光激发,基质将吸收的激光脉冲能量转移给待 测样本,在飞行时间质谱检测系统中按质荷比加以分离。离子捕获仪收集并储存脉冲信号,自动对其进行质谱分析。在确定的分子量范围(理论分子量±5Da)自动进行信噪比(SNR)值分析并通过SN 值的阳性判断值来判断待测样本的基因型。
4、腹腔内窥镜手术机器人的主要原材料
(1)主要原材料的选择
本产品主要原材料包括:PCR Enzyme、10×PCR Buffer、 MgCl2,25mM、dNTP Mix、Shrimp Alkaline Phosphatase、SAP Buffer、iPLEX Pro Enzyme、Buffer Plus(10×)、384 Termination Mix、引物、质粒、gDNA。主要原材料均为外购,引物、质粒由开发人自行设计,由专业的合成公司合成。开发人制定了各主要原材料质量要求并经检验合格。
(2)企业参考品和质控品设置情况
开发人设计了完整的企业参考品,包括:8 份基因型参考品,4份阴性参考品,5份检出限参考品,3份精密度参考品。 参考品采用临床样本和质粒样本制备而成。
8份基因型参考品中7份来源于不同基因型的临床样本, 1份来源于质粒样本。4份阴性参考品中1份来源于临床样 ,其余3份为各包含了 CYP2C19*7/10、CYP2C9*2、 CYP2C9*3 序列的混合质粒样本。5 份检出限参考品中 4 份来源于不同基因型的临床样本,1 份来源于质粒样本。3 份精密度参考品均来源于不同基因型的临床样本。所有参考品 7 原材料均通过一代测序确认基因型。各项企业参考品综合用于产品检测准确性、精密度和检出限的评价。
试剂盒包含1份阳性对照品和1份阴性对照品,用于检测过程的质量控制。阴性对照品为人gDNA,阳性对照品为质粒,阳性对照品涵盖该产品可检出的3个代表性的突变类型,阴性对照品为野生型样本。
5、腹腔内窥镜手术机器人的生产工艺及反应体系研究
开发人通过功能性试验确定最佳的生产工艺及反应体 系,包括:PCR 扩增反应体系中 PCR 引物、dNTP、PCR 酶的用量,PCR 退火温度、PCR 循环数;酶解反应体系中 SAP 酶的用量,酶解时间;延伸反应体系中延伸引物、延伸终止 液、延伸反应酶的用量,延伸反应温度、循环数。同时通过 临床样本确定了最优提取试剂盒、最佳 DNA 上样量和 DNA 纯度,确定了配套的树脂芯片,确定了飞行时间质谱检测系 统最佳的检测参数,确定了最大检测量及避免交叉污染的方式。
6、腹腔内窥镜手术机器人的分析性能评估
本产品分析性能包括准确度、检出限、检测上限、精密度、分析特异性(干扰实验、交叉反应)、适用的抗凝剂。 开发人开展了六批产品在适用机型上的性能评估。 采用 8 份基因型参考品,4 份阴性参考品,5 份检出限参考品,3 份精密度参考品对本产品进行检验,结果均符合要求。 在准确度研究中,开发人采用本产品与 Sanger 测序进行比较研究试验,使用至少三批试剂盒检测 29 份不同浓度 (15-60ng/μL)的临床样本,临床样本包含野生型和所有多态性位点的杂合突变、纯合突变。结果显示两种检测方法的符合率为 100%,表明两种方法具有较好的一致性。
在检出限研究中,开发人使用至少三批试剂盒进行评估。采用 5 例临床样本,分别进行梯度稀释,对系列浓度样 本分别进行3次重复检测,初步选择15ng/μL和20ng/μL 作 为进一步研究的浓度。采用 5 例临床样本,分别稀释至 15ng/ μL 和 20ng/μL ,对此浓度样本分别进行 20 次重复检测, 以阳性检出率≥95%的最低基因组浓度作为检出限,最终确定该产品检出限浓度为15ng/μL。
在检测上限评估中,开发人使用至少三批试剂盒进行评估。开发人从 62 例临床样本中选取浓度最高的 5 例临床样本分别进行 3 次重复检测,检测符合率为 100%的最高的两个浓度梯度再分别进行 20 次重 复检测。结果显示上样浓度高达 388ng/μL,申报试剂盒仍能准确检出,未出现非特异的结果。
在精密度研究中,开发人采用 5 份临床样本分别稀释为检出限浓度和中浓度,分别评价了本产品批内、批间、检测 轮次内(日内)、检测轮次间(日间)、仪器、地点、操作者; 提取试剂盒批内、批间等连续 21 天的精密度,结果显示检 9 测结果符合率均为 100%。本产品批内、批间、日内、日间精密度,提取试剂盒批内、批间精密度以及不同操作者、不 同地点、不同仪器之间的精密度均较好,试剂性能稳定。
在干扰研究中,开发人使用至少三批试剂盒对各种可能的内源性及外源性干扰物质进行评价。结果显示:血液样本中可能存在的内源性干扰物质血红蛋白、甘油三酯、胆红素、 白蛋白浓度分别为 200g/L、37 mmol/L、342μmol/L、60g/L 时 对本试剂不产生干扰。外源性干扰物质 EDTA-Na2、 EDTA-K2、氯吡格雷、替格瑞洛、阿司匹林,浓度分别为 25 mmol/L、2.2mg/mL、300ng/mL、627ng/mL、300ng/mL 时对本试剂不产生干扰。
在交叉反应研究中,开发人使用至少三批试剂盒对临床样本、混合大肠杆菌 DNA 的临床样本、以及具有 CYP2C19 的其他突变序列、CYP2C9 基因序列等同源序列的多份混合 样本进行检测,检测结果均与 Sanger 测序结果一致,符合率 100%。结果显示检测靶点之间不产生交叉反应,上述外源 DNA、同源序列与检测靶点之间均不产生交叉反应。
在适用的抗凝剂研究中,开发人采用 27 份临床样本进 行三种抗凝剂采血管的适用性研究。结果显示 EDTA 抗凝剂 采血管为最佳选择。
7、腹腔内窥镜手术机器人的阳性判断值研究
开发人采用已知基因检测结果的 99 份样本通过 ROC 曲 10 线分析获得阳性判断值为 SNR≥5。之后采用 132 例临床样本 进行阳性判断值适用性的验证,结果显示检测结果与 Sanger 测序结果符合率为 100%。因此阳性判断值设置合理。
8、腹腔内窥镜手术机器人的稳定性研究
开发人使用三批试剂盒对本产品在实际储存条件下保存至成品有效期后的效期稳定性、开瓶稳定性、反复冻融稳定性、运输稳定性、样本稳定性进行了系统的研究,确定了在各种条件下试剂的有效保存时间,反复冻融次数,样本保存温度和时间。
效期稳定性:开发人采用三批次试剂储存于-20±5℃条 件下,分别在 0、1、3、5、7、9、12、14 个月进行外观检 查、基因型参考品符合率、检出限和精密度检测,确定试剂 在-20±5℃条件下,可稳定保存 12 个月。
开瓶稳定性:开发人采用一批试剂在室温下融化,试剂充分融化后,开盖 10 min,然后盖好试剂,-20±5℃条件下 储存。分别在 0、1、2、3、4.5、5.5 和 6.5 个月的时间点取 出,进行外观检查、基因型参考品符合率、检出限和精密度 检测,确定试剂开瓶稳定性在-20±5℃条件下,可稳定保存 6 个月。
反复冻融稳定性:开发人采用一批试剂进行反复冻融, 分别在冻融次数 1、2、3、4、5、6 次时,进行外观检查、 基因型参考品符合率、检出限和精密度检测,确定试剂盒在 11 使用过程中可反复冻融 5 次。
运输稳定性:开发人采用一批试剂进行不同路线冷链往 返运输,最终确定试剂盒的运输要求为采用保温箱运输(-20 ±5℃),运输时间不超过 3.5 天。
样本稳定性:开发人采用 20 份临床样本在-20±5℃下保 存 0、2、3、4.5、5.5、6.5 个月时,分别进行检测;采用 4 份临床样本在 2~8℃下保存 0、2、4、7、9 天时,分别进行 检测。检测结果与 Sanger 测序结果进行比对,结果显示样本 在 2~8℃可保存一周,-20±5℃可保存 6 个月。

来源:嘉峪检测网


