今日头条
昌郁双靶点镇痛凝胶早期临床积极。昌郁医药具有创新双靶点的透皮产品XG004在治疗膝骨关节炎(OA)患者的Ib/IIa期临床结果积极。局部涂抹5%或10%XG004凝胶,每日一次、两次或三次,连续7天。与安慰剂相比,每日两次和三次涂药减轻了关节炎的症状;药物总体耐受性均良好,没有发现任何严重不良、停药或退出试验事件。
国内药讯
1.同源康EGFR抑制剂获批肺癌Ⅱ期临床。同源康医药自研1类化药TY-9591片获国家药监局临床试验默示许可,拟开展针对非小细胞肺癌适应症的关键性Ⅱ期临床,用于申请附条件批准上市。TY-9591是一款EGFR抑制剂,具有高脑渗透性和生物利用度高等特点。已完成的Ⅰ、Ⅱ期临床结果显示,TY-9591在肺癌脑转移患者中的颅内客观缓解率(iORR)高达100%,完全缓解率(CR)达14%,中位缓解深度为62%;且药物总体安全可控。
2.北京安龙眼科基因疗法获批临床。北京安龙生物1类生物制品“AL-001眼用注射液”获国家药监局临床试验默示许可,拟开发用于湿性年龄相关性黄斑变性(wAMD)的治疗。AL-001是一款基于昆虫细胞-杆状病毒表达载体系统开发的抗VEGF蛋白的AAV基因治疗产品,采用微创性脉络膜上腔(SCS)注射给药方式进行给药。该产品有望成为首款通过SCS注射给药方式,为wAMD患者提供基因治疗的门诊用药治疗选择。
3.珠海沙砾第二款TIL疗法中国报IND。沙砾生物1类生物制品GT201注射液的临床试验申请获CDE受理。GT201是沙砾生物自主研发的表达膜结合细胞因子的下一代基因编辑型TIL产品。在首个人体试验中,GT201已在多个晚期实体瘤患者中展示出稳定的扩增和初步临床疗效,并具有良好的安全性。2022年4月,沙砾生物开发的国内首个TIL药物GT101已获国家药监局批准开展治疗实体瘤的临床试验。
4.赛诺菲GPC3/TCR纳米抗体中国报IND。赛诺菲1类生物制品注射用SAR444200的临床试验申请获CDE受理。SAR444200是赛诺菲基于NANOBODY®技术开发的GPC3 T细胞接合剂,目前正在I期临床中评估治疗晚期实体瘤的安全性和有效性。GPC3靶向药类型包括CAR-T和抗体等类型,国内康诺亚、药明巨诺、原启生物、传奇生物、步长制药和复宏汉霖等均有布局。
5.再鼎引进苏州宜联DLL3靶向ADC。再鼎医药宣布与宜联生物达成战略合作和许可协议,将获得后者新一代DLL3抗体偶联药物(ADC)YL212的全球开发及商业化独家权益。根据协议,宜联生物将获得预付款和基于开发和销售的里程碑付款,以及产品净销售额的分级特许权使用费和潜在的第三方许可分成。DLL3是一种在小细胞肺癌 (SCLC) 和神经内分泌肿瘤中过度表达的Notch配体抑制剂。
6.杨森引进西比曼两款CAR-T产品。西比曼生物宣布与强生旗下杨森公司达成全球独家合作,共同开发和商业化下一代新型CAR-T细胞治疗产品C-CAR039(靶向CD19/CD20)和C-CAR066(靶向CD20),用于治疗非霍奇金淋巴瘤(NHL)。根据协议,杨森获得中国以外地区C-CAR039和C-CAR066独家开发权,以及中国地区开发的优先选择权;西比曼生物将获得2.45亿美元的首付款、潜在的里程碑付款和未来商业化后的销售分成。
国际药讯
1.辉瑞20价肺炎球菌疫苗获批儿科适应症。辉瑞20价肺炎球菌偶联疫苗Prevnar 20获FDA批准新适应症,用于预防20种肺炎链球菌血清型引起的侵袭性肺炎球菌病(IPD),适用于6周至17岁的婴幼儿和儿童,以及预防6周至5岁婴幼儿中由7种血清型引起的中耳炎。在Ⅲ期临床中,与活性对照(Prevenar 13)相比,3剂20vPnC接种后一个月,受试者的IgG的平均几何浓度(GMC)在19个血清型中达到非劣效性标准。所有20个血清型表现出强有力的功能性抗体反应。
2.大冢阿立哌唑长效预充针获批上市。大冢制药与灵北联合开发、已封装在注射器中的阿立哌唑2个月长效注射剂(aripiprazole,Abilify Asimtufii)获FDA批准上市,用于治疗成人精神分裂症或作为双相1型障碍患者的单药维持治疗。阿立哌唑是全球首个上市的多巴胺(DA)-5羟色胺(5-HT)系统稳定剂。在临床试验中,阿立哌唑即用型长效注射剂以预充式注射器(无需重装)的形式提供给患者,与每一个月注射一次的剂型(商品名为Abilify Maintena)相比具有一致的疗效。
3.杨森PARP抑制剂组合获FDA优先审评。强生旗下杨森PARP抑制剂尼拉帕利(niraparib)和醋酸阿比特龙构成的双效片剂(DAT)获得FDA授予的优先审评资格,与强的松联用,一线治疗携带BRCA基因突变的转移性去势抵抗性前列腺癌(mCRPC)患者。在III期MAGNITUDE研究中,与活性对照相比,niraparib组合显著延长HRR(同源重组修复)阳性患者的影像学无进展生存期(rPFS,HR=0.73,95% CI,0.56,0.96,p=0.022)和BRCA1/2突变患者的rPFS(19.5vs10.9个月)。
4.精神分裂症阴性症状新药重报NDA。Minerva Neurosciences公司5-HT2A/σ2受体拮抗剂roluperidone重新提交的新药申请(NDA)获FDA受理,用于治疗精神分裂症患者阴性症状。目前,美国尚无针对精神分裂症阴性症状的疗法获批。在Ⅲ期临床(MIN-101C03和MIN-101C07)中,roluperidone较安慰剂显著改善患者的阴性症状因素评分(NSFS)。此前,该新药已两次被FDA拒绝批准。
5.BMS创新贫血疗法在美报sBLA。百时美施贵宝血红细胞成熟剂Reblozyl(罗特西普)的补充生物制品许可申请(sBLA)获FDA受理,用于一线治疗可能需要输注血红细胞(RBC)的贫血伴极低至中危骨髓增生异常综合征(MDS)成人患者。FDA同时授予其优先审查资格,PDUFA日期为今年8月28日。罗特西普是一种激活素受体2B(ACVR2B)-Fc融合蛋白,目前已获批用于治疗输血依赖性β地中海贫血症患者,以及某些罕见血液疾病患者出现的贫血。
6.CD19靶向CAR-T获FDA快速通道资格。baletta Bio公司基于驯鹿生物全人源CD19序列开发的CAR-T候选产品CABA-201获FDA授予快速通道资格,拟用于治疗系统性红斑狼疮(SLE)和狼疮肾炎(LN)患者。今年4 月,FDA已批准CABA-201开展I/II期临床试验,评估CABA-201在活动性LN或不累及肾脏的活动性SLE患者中的疗效和安全性。驯鹿生物拥有在大中华区使用该许可序列开发Cabaletta产品并将其商品化的优先权。
7.安斯泰来约59亿美元收购眼科公司。安斯泰来拟通过美国控股子公司Berry Merger Sub以金额约59亿美元收购Iveric Bio公司。Iveric Bio公司专注于眼科创新药物开发。2023年2月,该公司补体C5抑制剂Avacincaptad pegol的新药上市申请获得FDA受理,用于治疗年龄相关性黄斑变性(AMD)继发的地图样萎缩(GA)。FDA同时授予其优先审查资格,PDUFA日期为2023年8月19日。
医药热点
1.香港新增一猴痘病例。香港特区政府卫生署卫生防护中心4月29日表示,正调查一宗猴痘确诊个案,并提醒市民提高警觉,避免与怀疑感染猴痘的人士作密切身体接触,同时建议高风险目标组人士接种猴痘疫苗。该个案涉及一名有长期病患的59岁男病人,卫生署已安排病人入住玛嘉烈医院。初步调查显示,4月2至19日期间,该男子曾数次到访广东省。
2.北大医学部异地布局。4月28日上午,北京大学宁波海洋药物研究院举行开园仪式。这是北大医学部首个异地科研机构,旨在打通产学研用最后一公里,推动技术产业化的重要探索与实践。研究院现有建筑面积7451平方米,已组建生物技术药物研究中心、大洋生物医药研究中心、高端药物制剂与药用材料研究中心及新药研发分析测试中心等四大中心。
3.南昌医学院新校区动工。4月29日上午,南昌医学院新校园(一期)建设项目开工仪式在红谷滩九龙湖片区南昌未来科学城隆重举行,旨在改善学校办学条件,为医学人才培养提供坚实基础。该项目是南昌市重点工程项目,对南昌未来科学城的打造具有重要意义。项目占地面积853.69亩,总建筑面积31.03万平方米,总投资约24亿元,可满足10000人办学规模。
评审动态
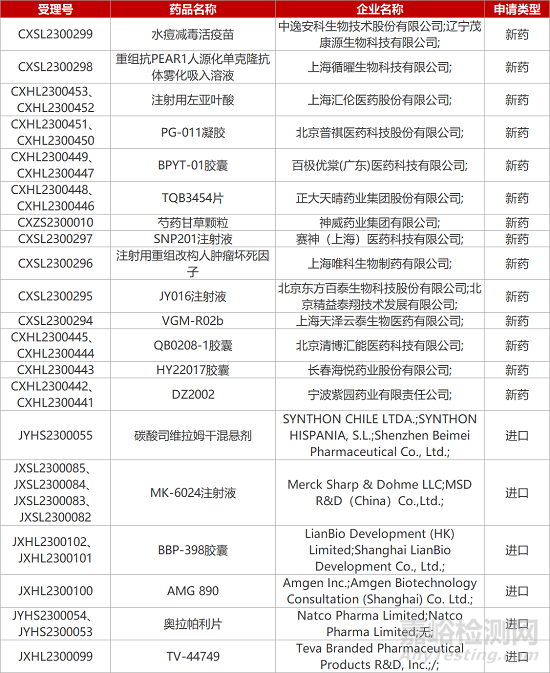
1. CDE新药受理情况(04月29日)
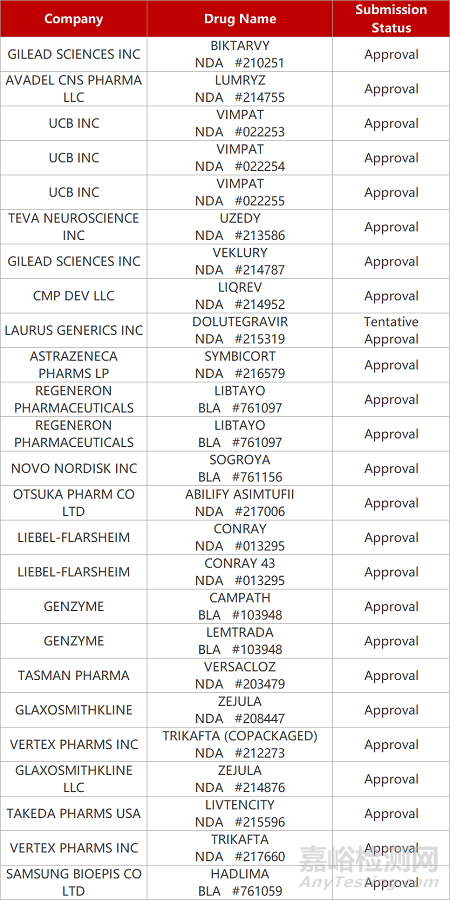
2. FDA新药获批情况(北美05月01日)