编者按
中药方剂化学组成高度复杂,药理作用具有多成分、多靶点的特点,使得阐明其生物活性化合物极具挑战性。茵陈蒿汤被广泛用于治疗黄疸相关疾病,尽管近年来茵陈蒿汤的药效及活性成分被不断证实,但仍缺乏对其效应成分、效应机制和功能靶点的深入系统分析,尤其是临床研究方面。
中国工程院院刊《Engineering》2022年第9期发表黑龙江中医药大学王喜军教授研究团队的《基于整合临床和动物实验的小分子筛选平台揭示经典方剂茵陈蒿汤治疗黄疸证显效状态下的活性化合物及潜在作用靶点》一文。文章建立了一种新颖的用于发现茵陈蒿汤的潜在靶点和活性小分子的研究策略,并有效解析了人类和小鼠胆汁淤积性相关黄疸病的代谢紊乱规律。首先采用基于超高效液相色谱-四极杆飞行时间质谱(UPLC-Q-ToF-MS)技术的代谢组学方法结合中药血清药物化学方法揭示茵陈蒿汤的血清代谢谱和化学成分谱。通过网络药理学和智能途径分析平台构建化合物-靶标-通路关联网络,发现了茵陈蒿汤中8个活性小分子与5个核心靶点极度相关,并通过酶联免疫吸附测定实验进行生物学验证。结果表明,茵陈蒿汤通过靶向胆固醇7α-羟化酶(CYP7A1)、多药耐药相关蛋白2(ABCC2)、多药耐药相关蛋白3(ABCC3)、尿苷二磷酸葡萄糖醛酸基转移酶1A1(UGT1A1)和法尼醇X受体(FXR)来调节包括初级胆汁酸生物合成、卟啉和叶绿素代谢以及胆汁分泌在内的代谢通路,从而发挥利胆退黄的作用。该整合策略可以成功地用于中药方剂活性小分子及其作用靶点的发现。
一、引言
由于中药和人类疾病的复杂性,目前还没有有效的研究策略来揭示中药方剂化学成分与药效之间的关系。与传统的药效追踪分离相比,中药血清药物化学是揭示中药方剂活性成分的有效工具,因为只有从血清中发现的成分才有可能成为潜在的药效物质。网络药理学被认为是深度挖掘中药方剂整体性和系统性本质的有效技术,其核心思想是阐明活性成分、分子靶标与疾病特征之间的生物学语言。与组学技术相结合,可以更有效地提高未知和已知靶点鉴定的准确性。代谢组学作为系统生物学的重要组成部分,主要用于探索整个生物系统中受干扰的生物标志物及其代谢通路的变化规律,特别适用于揭示生物体的临床表型。因而代谢组学在新药开发方面具有巨大潜力。血清药物化学、代谢组学和网络药理学的整合分析可以将活性化合物和靶标与内源性代谢物相关联,有利于挖掘出活性化合物的功能靶标。
胆汁淤积性黄疸是由于肝内外胆管梗阻或肝细胞受损导致胆汁酸异常积聚而引起的临床病症,主要表现为黄疸。茵陈蒿汤首载于东汉张仲景《伤寒论》,是治疗胆汁淤积性黄疸的经典方剂,全方由大黄(DH)、茵陈(YC)、栀子(ZZ)三味药组成。大量临床和动物研究表明,茵陈蒿汤在利胆去黄、抗肝损伤、抗肝纤维化、抗炎、胰腺保护和抗肿瘤等方面疗效显著。虽然茵陈蒿汤在治疗胆汁淤积性黄疸的相关动物模型和临床研究中的疗效已得到广泛证实,且无明显毒副作用,但中药复杂性和多样性的问题严重阻碍了对其活性成分和保肝机制的研究,这极大地制约了对其先导化合物的发现。
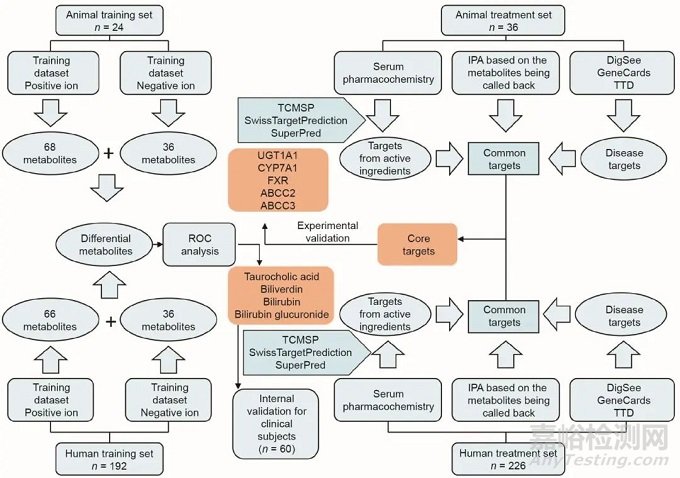
本研究开发了基于中药血清药物化学、代谢组学技术、网络药理学方法和实验验证于一体的破译中药方剂活性成分和核心靶标的新策略,研究设计的思路如图1所示。首先招募了226名受试者和60只小鼠,从临床和动物两个方面通过非靶标代谢组学技术揭示疾病生物标志物并评价方剂疗效。其次通过中药血清药物化学方法发现茵陈蒿汤的体内活性成分,并借助包括数据库挖掘、MetaboAnalyst 3.0软件Pathway Analysis模块(MetPA)和独创通路分析软件(IPA)组学平台的综合网络分析方法确定了潜在作用靶点。鉴于小鼠和人类生物过程之间的高度相似性,进一步整合临床和动物数据揭示茵陈蒿汤的活性化合物、作用靶标和疾病核心生物标志物。最后,对关键靶标进行实验验证,证明该研究策略的可行性。这种方法有助于挖掘中药生物活性化合物,并发现其治疗疾病的新靶点。
图1. 整合血清药物化学、代谢组学和网络药理学的研究策略。ROC:受试者工作特征曲线;IPA:基于云计算的一体化生物通路分析软件;UGT1A1:尿苷二磷酸葡萄糖醛酸基转移酶1A1;CYP7A1:胆固醇7α-羟化酶;FXR:法尼醇X受体;ABCC:多药耐药相关蛋白;TCMSP:中药系统药理学数据库和分析平台;有数据支持的疾病基因数据库(DigSee)、人类基因数据库(GeneCards)和药物靶标数据库(TTD)均是疾病靶点数据库。
二、实验方法
(一)药物和试剂
所有药材均购自哈尔滨同仁堂药店。包括:α-奈异硫氰酸酯(美国Sigma-Aldrich);乙醇和橄榄油(国药化学试剂北京有限公司);多药耐药相关蛋白2(ABCC2)、法尼醇X受体(FXR)、胆固醇7α-羟化酶(CYP7A1)、多药耐药相关蛋白3(ABCC3)和尿苷二磷酸葡萄糖醛酸基转移酶1A1(UGT1A1)试剂盒(江苏晶美生物科技有限公司);直接胆红素(DBIL)、碱性磷酸酶(ALP)、总胆红素(TBIL)、丙二醛(MDA)、总超氧化物歧化酶(T-SOD)和天冬氨酸转氨酶(AST)试剂盒(中生北控生物科技股份有限公司);总胆汁酸(TBA)、γ-谷氨酰转肽酶(γ-GT)、谷胱甘肽过氧化物酶(GSH-Px)、丙氨酸氨基转移酶(ALT)(江苏南京建成生物工程研究所)。
(二)实验动物与给药方案
无特定病原体(SPF)雄性Balb/c小鼠[体重为(20 ± 2)g]购自上海斯莱克实验动物有限责任公司。将60只动物分为两类数据集。其中数据集1包括对照组和黄疸组,数据集2包括对照组、黄疸组和茵陈蒿汤组。每组12只小鼠。对于黄疸组合茵陈蒿汤组,每只小鼠按每10 g体重给药0.1 mL灌胃,连续14天每天早上给予0.013 g·mL-1的干姜溶液和下午给予12.5%(体积分数)的乙醇溶液,第15天给予1.5 mg·mL-1的ANIT橄榄油溶液,第16天给予1.0 mg·mL-1的ANIT橄榄油溶液。空白组按每10 g体重给药0.1 mL灌胃,连续14天给予生理盐水,第15、16天给予橄榄油。茵陈蒿汤组从第17天开始按照每千克体重给药10 mg灌胃,连续7天给予茵陈蒿汤溶液(5 g·mL-1),而对照组按每10 g体重给药0.1 mL灌胃,给予蒸馏水。所有实验操作经黑龙江中医药大学动物伦理委员会批准,并按照《赫尔辛基宣言》原则进行。
(三)临床受试者与给药方案
2016—2018年在黑龙江中医药大学第一附属医院共纳入黄疸患者106例,健康受试者120例。纳入病例标准:血清TBIL水平约为171 µmol·L-1,同时血清ALP、γ-GT和DBIL水平也升高,临床可以明显观察到皮肤组织黄染。排除病例标准:妊娠及哺乳期妇女、参加其他药物试验或资料不全等影响疗效性和安全性判断者、肾或造血系统等严重原发性疾病者、精神病者。茵陈蒿汤由黑龙江中医药大学第一附属医院熬制包装。黄疸患者连续15天口服茵陈蒿汤治疗,每天两次,每次100 mL。受试对象分为两类数据集:数据集1包含120例健康受试者和72例黄疸患者;数据集2包含120例健康受试者、72例黄疸患者和34例接受茵陈蒿汤治疗的患者。
(四)样品制备
小鼠摘眼球取血,临床受试者静脉取血,新鲜血液样品静置30 min后离心(4 ℃,3000 r·min-1,15 min),取上清液-80 ℃贮存。样品分析前室温解冻,取小鼠200 μL血清加600 μL甲醇,涡旋30 s,静置30 min,于4 ℃、13 000 r·min-1离心5 min,移取上清液2 μL用于血液代谢分析。
临床血清样本2 mL,加入40 μL磷酸溶液,涡旋30 s混匀,上样到预先活化和平衡好的固相萃取柱上,用1 mL水淋洗,弃去淋洗液,再以2 mL甲醇进行洗脱,收集洗脱液并于45 ℃氮气下吹干,用150 μL甲醇复溶残渣,离心15 min(13 000 r·min-1,4 ℃),上清液过0.22 μm滤膜后,进样5 µL供血中移行成分分析。小鼠血清样本处理方式与临床血清样本一致。
(五)临床生化指标和组织病理学评价
按试剂盒说明检测ALP、ALT、AST、DBIL、TBIL、γ-GT、TBA、GSH-Px、MDA、T-SOD、UGT1A1、CYP7A1、FXR、ABCC3、ABCC2的值。小鼠采血后肝组织用苏木精-伊红染色,在光学显微镜下进行组织病理学观察。
(六)代谢组学分析
检测系统为Waters AcquityTM UPLC液相色谱仪(Waters集团公司,美国)和SynaptTM G2Si-HDMS质谱仪(Waters集团公司,美国)。小鼠和临床受试者血清样品分别在ACQUITY UPLC HSS T3色谱柱(100 mm × 2.1 mm,1.8 µm)(Waters集团公司,美国)和ACQUITY UPLC HSS C18色谱柱(100 mm × 2.1 mm,1.8 µm)(Waters集团公司,美国)上分离。代谢组学分析参数(见附录A中表S1至表S3),包括色谱条件(柱温、流速、梯度洗脱程序、进样量)以及质谱条件(离子源温度、脱溶剂温度、样品锥孔电压、毛细管电压),确保结果的稳定、准确和可重复。小鼠和临床受试者血液代谢分析的柱温分别设定为40 ℃和45 ℃,进样量均为2 μL。
(七) 代谢物及代谢通路分析
代谢物鉴定方法与先前研究报道的一致。通过多元统计方法结合精确的分子量、分子式[接近于零的i-FIT值,小于百万分之五(5 ppm)偏差]、二级碎片以及人类代谢组数据库(HMDB)、ChemSpider、京都基因和基因组百科全书(KEGG)和Metlin数据库进行代谢物表征。为了挖掘黄疸相关的核心代谢通路,利用MetaboAnalyst 3.0软件Pathway Analysis模块对回调血液标记物涉及的代谢通路进行富集分析,将其可视化并功能注释。
(八)茵陈蒿汤血中移行成分分析
血样在ACQUITY UPLC HSS C18色谱柱上分离,流速0.4 mL·min-1,柱温45 ℃。其他色谱和质谱参数见附录A中表S4和表S5。借助Progenesis QI软件结合MassLynx 4.1软件中元素组成模块及二级碎片对血中移行成分进行表征。
(九)小分子整合分析
首先利用中医药系统药理学数据库分析平台(TCMSP)、SwissTargetPrediction和SuperPred数据库搜索入血成分靶点信息,并利用人类基因数据库(GeneCards)、药物靶标数据库(TTD)、人类孟德尔遗传病的数据库(OMIM)搜索与胆汁淤积性黄疸疾病相关靶点,将作用靶点名称进行规范,合并去重。把药物成分与疾病的交集基因通过Cytoscape 3.0软件绘制成“活性成分-靶点-疾病”关系网络图。为了便于合理解释生物过程、分子功能和细胞成分中所涉及的功能靶标,借助基因间功能关联关系的数据库(STRING)进行基因本体论(GO)富集分析和KEGG通路富集分析,预测其作用机制。进一步整合MetaboAnalyst 3.0和IPA代谢组学分析平台,挖掘已鉴定生物标志物涉及的代谢通路,分析包括基因、蛋白质、生物标志物在内的各种小分子互作网络。通过网络药理学和血清药物化学相结合方式捕捉入血成分富集的代谢靶标和代谢通路,整合代谢组学数据分析平台的分析结果,最终构建茵陈蒿汤活性成分-靶点-代谢物相关联的核心机制网络图。
(十)数据分析
结果用统计产品与服务解决方案软件(SPSS)处理,以 ± SD表示,多组间比较使用单因素方差处理,两组之间的比较用t检验进行分析,P < 0.05时为差异显著。
三、实验结果
(一)临床化学及组织病理学
与健康对照组比较,黄疸组年龄、性别和体重指数、肝功能检查的各项指标[包括前白蛋白原(PA)、球蛋白(GLB)、白蛋白(ALB)和总蛋白(TP)]均无显著差异,而ALP、ALT、AST、TBIL、DBIL、间接胆红素(IBIL)、CHE、γ-GT存在极显著差异(P < 0.01),说明临床所采集的黄疸病例均满足诊断标准,可用于本实验研究。数据集2包含120例健康受试者、72名黄疸患者和34名接受茵陈蒿汤治疗的黄疸患者。经茵陈蒿汤治疗后,患者ALT、AST、TBIL、DBIL、IBIL表达水平呈明显下降趋势(P < 0.01或P < 0.05),皮肤黄染有所缓解。进一步建立黄疸相关模型组小鼠,可以观察到,与对照组比较,模型组小鼠血清AST、DBIL、TBIL、ALP、ALT、γ-GT、TBA含量明显升高(P < 0.01或P < 0.05),而T-SOD含量明显下调(P < 0.05);肝组织中MDA含量上调不明显,GSH-Px含量明显下调[P < 0.01;见附录A中图S1(b)和表S7]。组织病理学结果显示,模型组小鼠肝细胞出现大面积水肿现象,肝小叶结构紊乱,肝细胞已高度水肿至气球样病变,局部伴有炎细胞浸润现象[见附录A中的图S1(c)]。与模型组相比,茵陈蒿汤组小鼠坏死面积明显减小,水肿程度减少,肝脏各组织结构(小叶、肝板、血窦、小叶中央静脉、叶间静脉、动脉、胆管)清晰,未见明显异常,偶见少量炎细胞分布其中[见图S1(c)]。这些结果说明茵陈蒿汤治疗黄疸疗效显著。
(二)代谢轨迹和轮廓分析
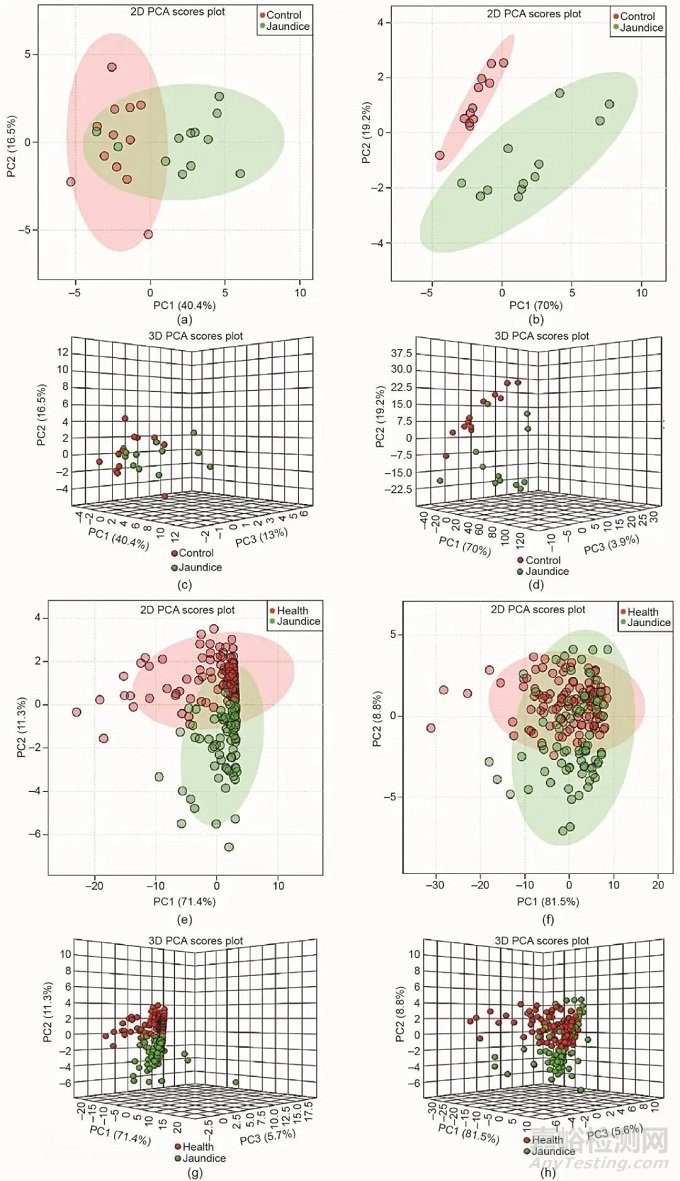
EZinfo软件通常用于对数据进行非监督型主成分分析(PCA),以便获得不同组代谢轨迹的直观聚类信息。如图2所示,从小鼠和人的二维PCA和三维PCA得分图中观察到黄疸组和对照组之间的代谢轮廓明显分离,这从血清基峰色谱图中得到进一步证实(见附录A中的图S1)。为了进一步评价茵陈蒿汤的疗效,本研究发现,无论临床黄疸患者还是黄疸模型小鼠给予茵陈蒿汤治疗后均出现了出现明显的回调趋势,表明茵陈蒿汤可以有效恢复黄疸病的病理进程(见附录A中的图S3)。
图2. 小鼠和临床受试者非靶标血液代谢组学的多变量分析轮廓图。负离子模式(a、c)和正离子模式(b、d)下小鼠二维和三维PCA得分图;负离子模式(e、g)和正离子模式(f、h)下临床受试者二维和三维PCA得分图。PC:主成分。
(三)代谢物鉴定和代谢途径分析
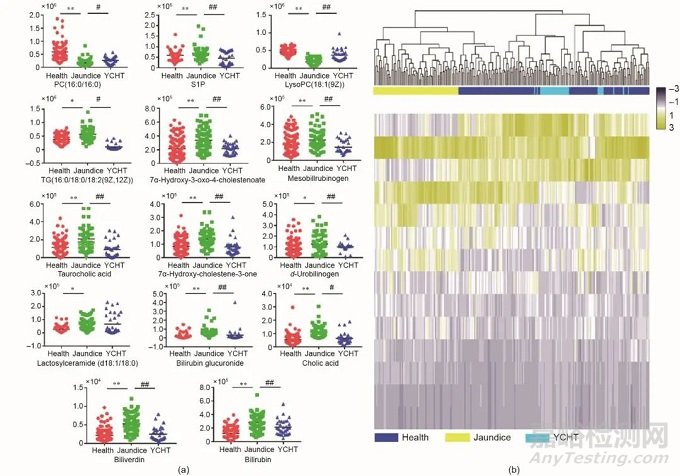
进一步进行偏最小二乘判别分析(OPLS-DA),获得正负离子扫描模式下的得分图、差异权重贡献值(VIP)散点图和S-Plot图,筛选出在两组间表达存在显著性差异(P < 0.05)且对分组贡献度(VIP > 1.0)大的内源性离子作为候选离子。最终根据数据库和二级碎片信息,确定小鼠12个生物标志物(正负离子模式分别为4个和8个),以及来自临床受试者的14个生物标志物(正负离子模式分别为7个和7个)(见附录A中的表S9)。如图3和图4所示,为了直观地阐述茵陈蒿汤如何影响代谢变化并明确回调的核心生物标记物,进一步绘制了生物标志物相对强度的散点图和热图。同时为了验证已鉴定代谢物的分类能力,以这些代谢物为评价基础,从192名受试者中随机选择60个临床样本进行代谢轮廓分析。结果显示数据集被分为两个聚类,其中32个样本被归为组1,28个样本被归为组2。通过观察两组中每个样本的信息,发现组1和组2中的样本分别是健康组和黄疸组受试者,本研究初步验证了筛选标记物的适用性(见附录A中的图S4)。
为了减少用于临床诊断和分析应用的代谢物数量,以接收者操作特征曲线下的面积(AUC)大于0.9为筛选原则,本研究对临床受试者14个生物标志物和小鼠的12个生物标志物进行了指标数降低。按照AUC值排序,在临床受试者中排名靠前的牛磺胆酸、胆红素葡糖醛酸苷、胆红素和胆绿素被认为是核心生物标志物[见附录A中的表S10和图S5(a)];在模型小鼠中排名靠前的是磷脂酰胆碱(16∶0/16∶0)、胆红素、磺甘胆酸盐(2-)、溶血磷脂胆碱[18∶1(9Z)]、胆绿素和牛磺胆酸[见附录A中的表S11和图S5(b)]。巧合的是胆红素、胆绿素和牛磺胆酸在临床受试者和小鼠样本中均被发现。聚焦临床核心标记物胆红素、胆绿素、胆红素葡萄糖醛酸苷、牛磺胆酸,借助MetaboAnalyst 3.0软件Pathway Analysis模块进行通路富集分析,发现这些标记物主要涉及卟啉和叶绿素代谢以及初级胆汁酸生物合成。本研究进一步借助KEGG数据库构建代谢通路和生物标志物的关联网络,如图5所示。
图3. 临床受试者数据集2各组血液代谢物含量的变化图。(a)健康受试者、黄疸患者和茵陈蒿汤治疗患者三组之间生物标志物相对强度散点图;(b)健康受试者、黄疸患者和茵陈蒿汤治疗患者三组之间生物标志物相对强度热图。结果用 ± SD表示。*P < 0.05和**P < 0.01与健康受试者相比;#P < 0.05和##P < 0.01与黄疸患者相比。S1P:鞘氨醇-1-磷酸酯;PC:磷脂酰胆碱;TG:甘油三酯。
图4. 小鼠数据集2各组血液代谢物含量的变化图。(a)对照组、模型组和茵陈蒿汤组三组之间生物标志物相对强度散点图;(b)对照组、模型组和茵陈蒿汤组三组之间生物标志物相对强度热图。结果用 ± SD表示。*P < 0.05和**P<0.01与对照相比;#P < 0.05和##P < 0.01与模型组相比。
图5 临床黄疸患者和黄疸模型小鼠相关代谢通路网络图。蓝色框内代表的是黄疸小鼠主要代谢通路,包括脂质代谢(a)和胆汁酸代谢(b)。橙色框内代表黄疸患者主要代谢通路,包括脂质代谢(c)和胆汁酸代谢(d)。利用MetaboAnalyst 3.0软件Pathway Analysis分析了存在于黄疸小鼠(e)和临床黄疸患者(f)体内的代谢通路概况。方框内ID号代表本项研究中检测到的代谢标志物的KEGG号,其中,红框中的ID号代表差异表达的代谢物,其他框内的ID号代表在本项研究中未被检测到的代谢物。箭头上的符号代表KEGG提供的关键酶;红色方框旁边的箱型图呈现了对照组(红色)和黄疸组(绿色)之间的相对差异强度。LacCer:乳糖酶基(神经)鞘氨醇;CoA:辅酶A。
(四)潜在靶标预测
为了进一步挖掘黄疸病的潜在功能机制,本研究借助IPA组学分析平台对黄疸模型小鼠和黄疸患者内在功能变化及典型通路(见附录A表S12和S13)进行分析,识别出核心生物标记物牛磺胆酸、胆酸、胆红素葡萄糖醛酸苷、胆红素和胆绿素参与胆汁淤积相关的胆汁酸生物合成、血红素降解、白细胞介素-10信号传导和法尼醇X受体/维甲酸X受体(FXR/RXR)的激活,并构建了生物标志物预测网络。根据典型代谢通路和关联网络模块分析结果(见附录A中的图S6、S7),本研究发现UGT1A1、ABCC3等下游蛋白参与血红素降解通路,调节胆红素的表达,下游蛋白ABCC3、FXR以及上游蛋白CYP7A1参与初级胆汁酸生物合成和FXR/RXR的活化,调节牛磺胆酸的表达。给药治疗后,发现茵陈蒿汤能激活FXR、ABCC3和UGT1A1,抑制CYP7A1的活性,表明这三类通路在调节胆汁酸平衡中起着至关重要的作用(见附录A中的图S8、S9)。代谢组学结合IPA平台分析,可以推断茵陈蒿汤可通过调节胆汁酸的初级生物合成、血红素降解和FXR/RXR途径,阻止小鼠和人类黄疸病的发生发展。
(五)茵陈蒿汤血中移行成分分析
数据导入Progenesis QI软件进行预处理,通过主成分分析和有监督的OPLS-DA筛选变量(图6)。一般模型组中不存在但给药组中存在的变量被视为潜在的入血成分。结合先前茵陈蒿汤体外成分分析结果,在临床受试者中共表征了26种原型成分和三种代谢物,在模型小鼠中共表征了33种原型成分和三种代谢物(见附录A中的表S14、S15)。
(六)网络药理学靶标分析
本部分整合网络药理学和血清药物化学的方法,首先通过数据库搜索入血成分作用靶标以及黄疸疾病相关靶标,两者取交集,在小鼠和人类中鉴定出79个共同靶标。为了阐明茵陈蒿汤的潜在功能机制,构建了方剂-单味药-化合物-靶点-黄疸病网络,如图7所示,详细信息见附录A中的表S16、S17。进一步提取共同靶标用于GO和KEGG富集分析,按照-lgP的降序排序以区分差异。使用在线绘图网站Omishare工具可以看到排名靠前的位置(见附录A中图S10)。小鼠和临床受试者GO富集分析的结果显示,主要定位在生物过程中,如对化学物质的反应、对化学刺激的细胞反应和对脂质的反应;细胞成分中细胞部分和细胞外区部分的-lgP评分和基因数量最高;分子功能分析中酶结合和蛋白质结合突出。根据KEGG途径富集分析的气泡图,本研究发现排名靠前的主要代谢通路包括胆汁分泌、卟啉和叶绿素代谢以及初级胆汁酸生物合成。动物和临床试验结果可相互验证。
图6. 基于血清药物化学方法建立的UPLC-MS色谱图及其多变量分析轮廓图。(a)小鼠茵陈蒿汤组和黄疸组的色谱图;(b)小鼠茵陈蒿汤组和黄疸组之间的S-plot图;(c)小鼠中已鉴定化合物15.55_283.0253在茵陈蒿汤组和黄疸组之间相对含量的趋势图;(d)小鼠茵陈蒿汤组和黄疸组之间的PCA得分图;(e)临床茵陈蒿汤组和黄疸组的色谱图;(f)临床茵陈蒿汤组和黄疸组之间的S-plot图;(g)临床样本已鉴定化合物15.55_283.0253在茵陈蒿汤组和黄疸组之间相对含量的趋势图;(h)临床茵陈蒿汤组和黄疸组之间PCA得分图。P:S-plot图中的第一主成分;P (corr):S-plot图中第一主成分的偏相关系数。
图7. 茵陈蒿汤入血成分和黄疸病共同作用靶标网络图。(a)小鼠黄疸病和入血成分的特有和共同靶标。网络图呈现36个茵陈蒿汤入血成分(橘色),以及与茵陈蒿汤(红色)关联的三种单味药(浅蓝色)和与胆汁淤积性黄疸(红色)相关的323个特有靶标(蓝色),两者有79个共同靶标(绿色)。(b)临床黄疸病和入血成分的特有和共同靶标。网络图呈现29个茵陈蒿汤入血成分(橘色),以及与茵陈蒿汤(红色)关联的三种单味药(浅蓝色)和与胆汁淤积性黄疸(红色)相关的323个特有靶标(蓝色),两者有79个共同靶标(绿色)。
(七)整合分析
通过对基于血清药物化学的网络药理学和血液代谢组学数据之间的交叉分析,推测卟啉和叶绿素代谢、胆汁分泌和初级胆汁酸生物合成可能是胆汁淤积性黄疸病的发病机制及茵陈蒿汤的作用机制。从人体和动物两个维度,聚焦生物标志物和上游靶点,进而提取了两类受试对象共同的核心靶点,包括ABCC2、ABCC3、UGT1A1、FXR和CYP7A1。与核心靶标相关的活性成分包括京尼平苷、滨蒿内酯、异鼠李素、槲皮素、柚皮素、大黄酸、绿原酸和山奈酚。与上述相关的胆红素、胆绿素、胆红素葡萄糖醛酸苷和牛磺胆酸代谢物可作为胆汁淤积性黄疸病核心生物标志物,由此构建了茵陈蒿汤的功能机制图,如图8所示。以胆红素、胆绿素、胆红素葡萄糖醛酸苷和牛磺胆酸在内的4种临床关键代谢物为基础模型进行内部验证,从226名受试者中随机抽取60名受试者进行PCA分析。结果表明构建的模型可以有效区分健康受试者和黄疸患者整体代谢轮廓[见附录A中的图S11(a)]。此外,ROC分析显示AUC值等于0.996,表明所选代谢物的模型可用作诊断黄疸病方法的有效补充[见附录A中的图S11(b)]。
(八)靶标验证
为了对预测靶标进行验证,本研究采用了酶联免疫吸附测定试剂盒对靶蛋白表达水平进行检测。与健康对照组相比,黄疸患者血清中ABCC2、ABCC3、UGT1A1和FXR表达水平显著降低,CYP7A1表达水平显著升高(P < 0.01或P < 0.05)。给药治疗能回调相应靶蛋白的表达。因此可以推断茵陈蒿汤可通过调节CYP7A1、ABCC2、ABCC3、UGT1A1和FXR的活性来促进胆汁分泌和抑制胆汁酸生物合成,达到治疗黄疸病的效果。
图8. 整合代谢组学、血清药物化学和网络药理学的研究策略,发现茵陈蒿汤潜在靶标和活性化合物。(a)茵陈蒿汤治疗黄疸病的功能机制图;(b)新颖的靶标和潜在活性化合物之间的靶向关系。
四、讨论
胆汁淤积性黄疸患者肝细胞内的胆汁流阻滞,导致有毒胆汁酸积聚,从而加重黄疸症状。研究发现通过抑制胆汁生成、刺激胆汁分泌可改善肝细胞功能,减轻机体胆汁酸代谢紊乱。基于此,茵陈蒿汤可通过调节胆汁酸的生成和分泌来发挥治疗作用。大量研究发现,茵陈蒿汤能明显改善黄疸症状,相关黄疸生物标志物也有所回调。本课题组前期通过IPA软件和PCMS代谢组学分析平台挖掘出了茵陈蒿汤的潜在靶点和活性成分。然而,茵陈蒿汤治疗胆汁淤积性黄疸的潜在机制尚未清楚阐明,这些结果只是在相关动物模型中探究出来的,需要进一步结合临床加以验证。为此本文从临床和动物两个角度建立整合中药血清药物化学、网络药理学和代谢组学的研究策略对其进行探究。疾病的表型是机体内源性异常紊乱整体作用的结果,因而疾病表型的研究需要从系统水平上进行全面的多角度分析,进行深度数据挖掘,才能逐步被转化为点对点的靶向验证。
基于临床和动物的多层次分析,本研究建立了一个茵陈蒿汤潜在功能机制的网络图(图8)。有趣的是,通过对两类研究对象的富集分析,推断ABCC2、ABCC3、CYP7A1、UGT1A1和FXR可能是茵陈蒿汤的作用靶点,其生物活性成分可调节多条信号通路,从而在黄疸病的治疗中表现出协同增效的作用。这些发现阐明了茵陈蒿汤治疗胆汁淤积性黄疸的新的分子机制。此外,从代谢组学角度,对这两类受试对象进行多步实验进行了系统验证,发现胆红素、胆绿素和牛磺胆酸可作为诊断胆汁淤积性黄疸病理变化的新型潜在生物标志物。牛磺胆酸是胆汁分泌的重要信号分子,被认为是胆汁淤积性黄疸期间胆汁酸排泄异常的临床诊断指标,同时具有免疫调节和抗炎作用。在这些鉴定的生物标志物中胆红素和胆绿素也在临床黄疸诊断中发挥重要作用。胆红素是胆绿素通过胆绿素还原酶合成的代谢产物,在胆汁淤积性黄疸期间,胆汁酸的积累导致线粒体功能障碍和胆红素葡萄糖醛酸化阻滞,会刺激胆绿素转化为胆红素,以发挥抗氧化和细胞保护作用。几项研究表明,与黄疸疾病相关的代谢物,包括犬尿烯酸和D-葡萄糖醛酸在动物血清和尿液中均被检测到异常表达。当前研究明确了胆红素、牛磺胆酸、胆红素葡萄糖醛酸苷和胆绿素在预测和诊断临床黄疸疾病的作用。当然其他相关代谢物包括L-同型半胱氨酸、胆酸、溶血磷脂酰胆碱[18∶1(9Z)]和溶血磷脂酰胆碱[16∶1(9Z)]在人和小鼠之间存在差异,这可能归因于物种之间的内在差异。
整合中药血清药物化学、网络药理学和代谢组学研究,不仅进一步验证了茵陈蒿汤的疗效,而且有助于更好地挖掘其功能机制。基于此,本研究通过实验发现了一种新的代谢机制参与茵陈蒿汤的治疗。临床黄疸受试者和黄疸小鼠鉴定的代谢物均显示胆汁酸和脂质代谢紊乱,这与胆汁酸生物合成和胆汁分泌失调有关。实验结果显示黄疸患者或黄疸小鼠胆汁酸水平高于对照组,说明胆汁酸生物合成和胆汁分泌异常与胆汁淤积性黄疸密切相关。大量研究表明,抑制胆汁酸合成,促进胆汁分泌有利于改善胆汁淤积性黄疸病的症状。网络药理学进一步证明,茵陈蒿汤参与调节胆汁酸的分泌和合成,涉及的作用靶标包括ABCC2、ABCC3和CYP7A1。多药耐药相关蛋白(MRP)家族,属于三磷酸腺苷结合盒转运体(ABC)的一类有机阴离子转运体超家族,包括ABCC2、ABCC3等,负责葡萄糖醛酸苷的转运。ABCC2又称多药耐药相关蛋白2(MRP2),参与肝细胞内胆红素、胆汁酸硫酸盐等多种两亲性阴离子的分泌,以维持胆汁酸稳态,在胆汁分泌中起着举足轻重的作用。CYP7A1是胆汁酸生物合成经典途径中的限速酶,具有调节胆固醇稳态和胆汁酸合成的功能。与大量黄疸模型实验结果一致,与对照组相比,黄疸组ABCC2的表达水平显著降低,CYP7A1的表达水平显著升高,茵陈蒿汤治疗后有所回调,这一结果在本实验的动物和临床数据中得到进一步支持。由于ABCC2的激活,二价胆盐在胆管侧膜细胞的分泌能力增强,这可以解释为什么茵陈蒿汤组血清胆汁酸水平下调。ABCC3通常不在正常肝细胞膜中表达,一旦发生胆汁淤积,肝细胞基底膜中ABCC3的表达水平明显升高。此外,由于ABCC3转运底物与ABCC2转运底物具有广泛的同源性,一般认为ABCC3的高表达水平可补偿ABCC2,以减轻胆汁淤积性黄疸期间胆碱诱导的肝毒性损伤。这进一步说明了ABCC3在保护胆汁淤积性黄疸中的重要作用,正如本研究从不同组间ABCC3蛋白表达水平的比较中所证实的那样。
由于胆汁生成、分泌和排泄障碍导致胆汁酸量积聚,形成肝内胆汁淤积。相应地,胆汁流不能正常输送到十二指肠,而流回血液,增加了血液中胆汁酸的水平。胆汁酸含量过高会激活FXR,直接降低CYP7Al活性,从而抑制胆汁酸生物合成。FXR是激素核受体超家族的一员,通过诱导特殊靶基因的表达,在胆汁酸的合成、转运和分泌中发挥关键作用。激活FXR能抑制胆汁酸生物合成,并促进胆汁酸分泌到胆管,从而保护肝细胞免受胆汁酸的损伤。当前实验结果证实茵陈蒿汤可通过激活FXR来协同调节CYP7A1活性,从而改善胆汁淤积性黄疸的症状并恢复胆汁酸紊乱。到目前为止,众多的证据表明胆汁酸的改变可以激活或抑制FXR来调节CYP7A1活性。此外,与黄疸组相比,在茵陈蒿汤治疗后的黄疸受试者中观察到了CYP7A1下调和FXR上调的相反变化,说明两者之间存在一定的关联。
黄疸病内源性病理机制复杂,本研究发现茵陈蒿汤通过调节卟啉和叶绿素代谢,可减轻小鼠和人类黄疸的严重程度(因为胆汁淤积性黄疸病的病理变化主要是由胆红素功能障碍引起的)。进一步分析发现,茵陈蒿汤同时调节卟啉和叶绿素代谢中的胆红素、胆绿素和胆红素葡萄糖醛酸苷表达。UGT1A1作为卟啉和叶绿素代谢的关键限速酶,能促进肝脏中胆红素葡萄糖醛酸苷的形成以及ABCC2或ABBC3介导的胆汁分泌。从这个角度来看,UGT1A1和ABC转运蛋白在肝脏胆红素代谢异常的功能调节中发挥核心作用。抑制UGT1A1可以阻止胆红素和葡萄糖醛酸的结合,从而导致胆红素水平升高。靶向卟啉和叶绿素代谢的药物将阻断它们的过表达,可作为治疗黄疸病的候选药物,因此UGT1A1可能成为发现黄疸药物的有效靶点。茵陈蒿汤治疗后显著增加UGT1A1的活性,促进胆红素的下调和胆红素葡萄糖醛酸苷的上调,同时,ABCC2或ABCC3介导的胆红素葡萄糖醛酸苷分泌的改善对于黄疸病症状的缓解也至关重要。
总之,茵陈蒿汤通过增强FXR、UGT1A1、ABCC2和ABCC3的活性以及抑制CYP7A1的活性来发挥治疗胆汁淤积性黄疸的作用。当然需要进一步研究去评价茵陈蒿汤的活性成分,包括京尼平苷、滨蒿内酯、异鼠李素、槲皮素、柚皮素、大黄酸、绿原酸和山奈酚在核心代谢通路上发挥的作用。其中京尼平苷和滨蒿内酯治疗黄疸相关疾病的有效性已经得到了验证。该研究对于开展中药方剂体内活性小分子的发现及其治疗靶点的研究具有重要参考价值。
五、结论
本研究建立了一种新颖的用于发现茵陈蒿汤的潜在靶点和活性小分子的研究策略,并有效解析了人类和小鼠胆汁淤积性相关黄疸病的代谢紊乱规律。值得注意的是,本研究发现茵陈蒿汤8个关键成分可以靶向调控核心靶标CYP7A1、ABCC2、ABCC3、UGT1A1和FXR,参与调节胆汁酸的初级生物合成、卟啉和叶绿素代谢以及胆汁分泌代谢途径。该策略为有效发现中药的活性化合物和治疗靶点提供方法学支撑。