2023年6月30日,周五了,国家药监局是不是会布置作业呢?果不其然,国家药监局官网发布“公开征求《药品检查管理办法(试行)》部分条款修订意见”(成文日期:2023年6月29日),征求截止日期:2023年7月10日。此办法为贯彻《药品管理法》《疫苗管理法》,进一步规范药品检查行为,推动药品监管工作尽快适应新形势。本文为大家梳理了本办法中与药企有关条款内容并结合自己的解读与大家分享。
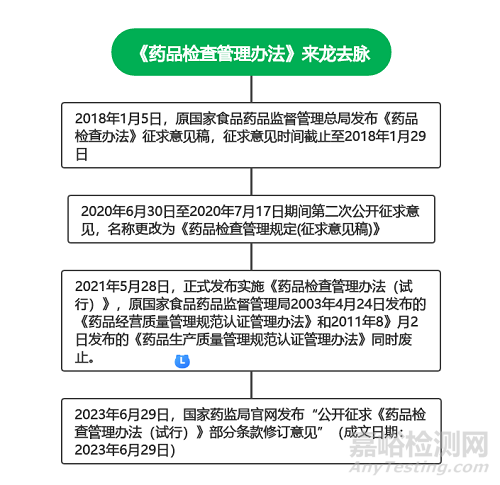
一、《药品检查管理办法》来龙去脉
新版《药品管理法》第九十九条明确药品监督管理部门应当依照法律、法规的规定对药品研制、生产、经营和药品使用单位使用药品等活动进行监督检查,必要时可以对为药品研制、生产、经营、使用提供产品或者服务的单位和个人进行延伸检查,为了进一步规范药品检查行为,推动药品监管工作尽快适应新形势,国家局有必要出台相关药品检查管理制度,政策来龙去脉梳理如下:
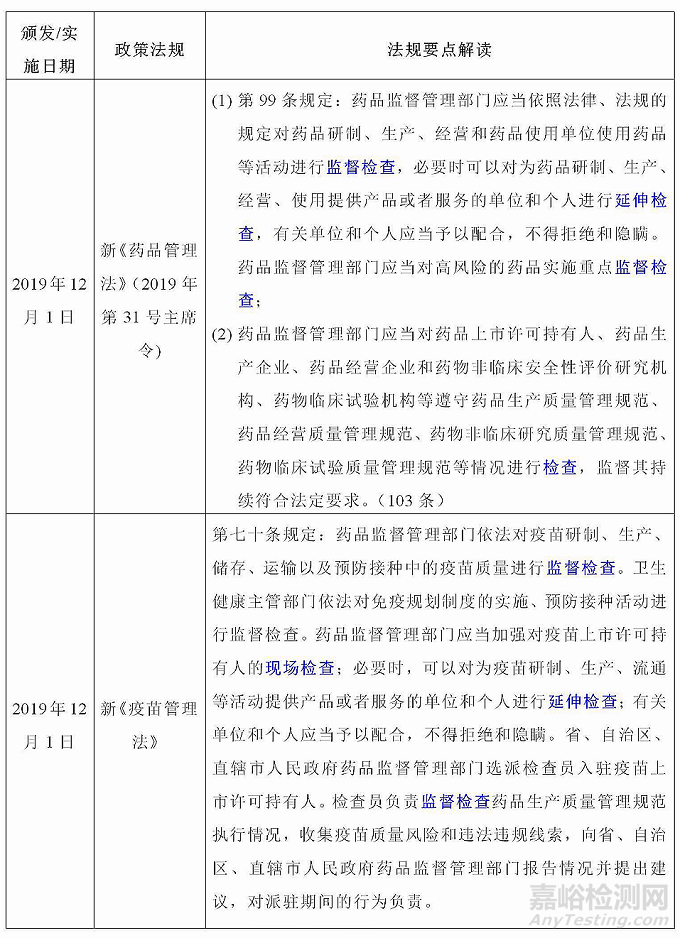
二、药品检查相关法规要求
药品检查是药品监督管理部门对药品生产、经营、使用环节相关单位遵守法律法规、执行相关质量管理规范和药品标准等情况进行检查的行为,新发布实施的两法(《药品管理法》《疫苗管理法》)和两办法(《药品生产监督管理办法》《药品注册管理办法》)药品检查相关内容,梳理如下:

三、药品检查规则有哪些新变化?
2021年5月28日正式发布实施《药品检查管理办法(试行)》后2年多,为贯彻落实《药品管理法》《药品生产监督管理办法》,进一步规范药品检查行为,国家药监局组织对《药品检查管理办法(试行)》部分条款进行修订,修订部分以对照表形式给出,其中,现场检查结论和综合评定结论的标准分开,单独列出了综合评定结论的标准,新旧版如下表:
参考文献
[1] www.nmpa.gov.cn