今日头条
琅钰引进OSA新药博鳌临床数据积极。琅钰集团从Bioprojet引进的选择性组胺H3受体反向激动剂盐酸替洛利生片,在博鳌用于治疗发作性睡病患者的临床研究获积极结果。8周治疗数据显示,患者日间过度嗜睡得到显著改善的比例达到83%,患者ESS评分(国际通用量表Epworth嗜睡量表)从19.0分基线下降的幅度为7.6分(校准后),具有统计学差异;临床中未出现任何严重不良事件。
国内药讯
1.恒瑞PD-1单抗肺癌Ⅱ期研究见刊。恒瑞医药PD-1抑制剂卡瑞利珠单抗联合化疗用于新辅助治疗ⅢA/ⅢB(T3N2)期非小细胞肺癌的Ⅱ期临床(TD-FOREKNOW)研究成果在线发表于JAMA Oncology。与化疗相比,卡瑞利珠单抗联合化疗新辅助治疗显著提高病理完全缓解(pCR)率(32.6%vs8.9%)、主要病理缓解(MPR)率(65.1%vs15.6%)和客观缓解(ORR)率(72.1%vs53.3%),且安全性良好。
2.杨森眼科基因疗法中国获批临床。强生旗下杨森从Hemera Biosciences引进的基因疗法JNJ-81201887(AAVCAGsCD59)获国家药监局批准开展临床试验,用于治疗继发于年龄相关性黄斑变性的地图样萎缩成人患者。JNJ-81201887(JNJ-1887)是一次性门诊玻璃体内注射疗法,旨在增加可溶性CD59(sCD59)的表达,保护视网膜细胞,从而减缓和预防疾病进展。此前,该药物已获FDA授予快速通道资格,以及欧洲药品管理局授予的先进治疗药物资格。
3.武汉睿健iPSC疗法获批PD临床。睿健医药人源多巴胺能前体细胞注射液(NouvNeu001)获国家药监局临床默示许可,拟开发用于治疗帕金森病(PD)。NouvNeu001是睿健医药利用“AI+化学诱导”平台开发的一款通用型细胞治疗产品,通过化合物调节实现高纯度神经元亚型分化,与体内原有神经元形成连接,产生综合性的治疗功能,改善帕金森症状。
4.上海医药CD19/CD22靶向CAR-T报IND。上海医药自主研发、靶向CD19和CD22的嵌合抗原受体自体T细胞(CAR-T)注射液B019的临床试验申请获CDE受理。B019的嵌合抗原受体结构采用一个双顺反子载体结构,可以在T细胞上表达两个独立的嵌合抗原受体,在互不影响的情况下分别结合B淋巴细胞表面表达CD19或CD22;同时针对CD19和CD22靶点进行组合治疗,可以覆盖原发与复发的B细胞恶性血液肿瘤患者的各种细胞亚群。
5.正大天晴引进益方KRAS G12C抑制剂。正大天晴与益方生物就后者临床期KRAS G12C抑制剂D-1553达成合作协议,获得该新药在中国大陆地区开发、注册、生产和商业化的独家许可权。D-1553目前正针对非小细胞肺癌(NSCLC)、结直肠癌等适应症在美国、澳大利亚、中国等多个国家开展国际临床试验。根据协议,益方生物将获得最高不超过5.5亿元人民币的首付款及里程碑款,以及产品的销售分成。
国际药讯
1.全球首款口服产后抑郁新药获批上市。Sage公司与渤健开发的新一代神经活性类固醇γ-氨基丁酸A型(GABAA)变构调节剂Zurzuvae(zuranolone)获FDA批准上市,成为首款获批用以治疗产后抑郁症(PPD)的口服疗法。GABA系统是大脑和中枢神经系统(CNS)的主要抑制性信号通路,对调节CNS功能有重要作用。在SKYLARK研究中,与安慰剂相比,50mg zuranolone治疗组第15天时HAMD-17评分较基线显著降低(-15.6vs-11.6)。
2.Taiho公司口服核苷复方获批新适应症。Taiho公司口服核苷类复方Lonsurf(trifluridine/tipiracil)获FDA批准新适应症,与贝伐珠单抗联用治疗成人晚期结直肠癌(mCRC)经治患者。在Ⅲ期SUNLIGHT试验中,与Lonsurf相比,组合疗法使患者死亡风险降低39%(HR=0.61,95% CI:0.49-0.77,p<0.001),两组的总生存期(OS)分别为10.8个月和7.5个月。此前,Lonsurf已获批用于治疗转移性结直肠癌患者。
3.默沙东两款呼吸系统FIC新药报产。默沙东靶向TGF-β的潜在“first-in-class ”ACVR2A-Fc融合蛋白sotatercept(MK-7962)用于辅助治疗肺动脉高压(PAH)的BLA申请获FDA受理。在III期STELLAR研究中,sotatercept较安慰剂显著改善患者24周后6MWD(6分钟步行距离)指标,达到主要终点和多个次要终点。此外,FDA也重新受理了默沙东的选择性P2X3受体拮抗剂gefapixant(MK-7264)用于治疗难治性慢性咳嗽(RCC)的上市申请,PDUFA日期为2023年12月27日。
4.RSV长效抗体获美国CDC推荐。美国疾控中心(CDC)免疫实践咨询委员会(ACIP)推荐将阿斯利康与赛诺菲开发的长效呼吸道合胞病毒(RSV)抗体Beyfortus(nirsevimab)纳入疫苗管理,用于即将进入或在首个RSV流行季期间出生的新生儿和8个月以下婴儿接种预防由RSV引起的下呼吸道疾病。ACIP还一致推荐将Beyfortus纳入儿童疫苗计划(VFC),旨在确保所有儿童都有机会按时接种推荐的疫苗。
5.礼来RET抑制剂肺癌Ⅲ期临床积极。礼来RET抑制剂Retevmo(selpercatinib)治疗RET融合阳性非小细胞肺癌(NSCLC)的Ⅲ期临床(LIBRETTO-431)达到主要终点。与标准一线疗法相比,Retevmo一线治疗显著提高这类患者的无进展生存期(PFS)。去年9月,FDA已同意将Retevmo用于RET基因融合的局部晚期或转移性NSCLC的加速批准转为完全批准,并加速批准Retevmo扩展适应症,用于治疗RET基因融合的局部晚期或转移性实体瘤患者。
6.安进DLL3/CD3双抗肺癌Ⅱ期临床积极。安进在第二季报中透露,其靶向DLL3和CD3的潜在“first-in-class”双特异性T细胞衔接蛋白(BiTE)tarlatamab(AMG 757)在治疗复发或难治性小细胞肺癌(SCLC)的Ⅱ期临床中获得积极结果,并未发现新的安全性信号。详细数据将在医学会议中公布。在I期临床中,Tarlatamab达到23%的确认ORR为23%和52%的疾病控制率。百济神州拥有该药的中国商业化权益。
医药热点
1.中疾控公布7月全国新冠感染情况。8月3日,中疾控发布7月份《全国新型冠状病毒感染疫情情况》。与6月份监测报告相比,7月份新冠病毒感染疫情整体继续呈现低水平流行态势;7月份新增重症病例455例、死亡病例65例,与6月相比均明显下降;7月份发热门诊就诊量持续下降至12.4万;变异株监测情况:XBB及其亚分支的占比继续增加,继续从2023年第27周(7月3日-7月9日)的96.3%,增长到第30周(7月24日-7月30日)的99.1%。
2.4家中国药企上榜世界500强榜单。8月2日,2023年《财富》世界500强榜单发布,17家制药公司上榜,其中,4家中国药企榜上有名,分别为中国华润有限公司(74名)、中国医药集团有限公司(113名)、广州医药集团有限公司(426位)、上海医药集团股份有限公司(438名)。上榜的跨国公司分别有辉瑞(102位)、强生(112位)、罗氏(184位)、默沙东(231位)、艾伯维(240位)、拜耳(265位)、诺华(271位)、赛诺菲(299位)、百时美施贵宝(312位)、赛默飞(328位)、阿斯利康(331位)、葛兰素史克(343位)、费森尤斯(346位)。
3. 许树强任中国医院发展研究院院长。近日,上海交通大学中国医院发展研究院院长聘任仪式举行,经组织批准,国家卫生健康委体制改革司原司长许树强被聘任为上海交通大学讲席教授、中国医院发展研究院院长。中国医院发展研究院是上海交通大学医学院的下设研究机构和智库平台,始终对标“健康中国”国家战略,以担当好新时代的高校智库责任为使命,努力打造国内一流的医疗卫生智库。
评审动态
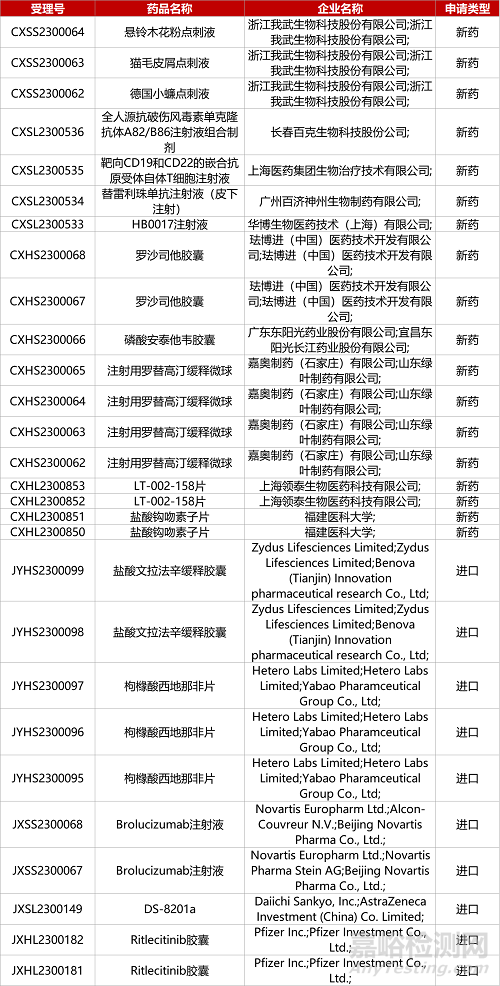
1. CDE新药受理情况(08月02日)
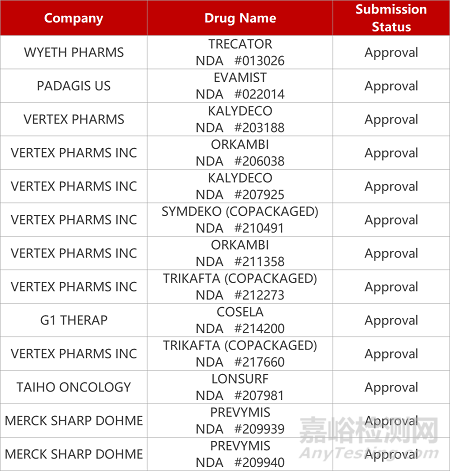
2. FDA新药获批情况(北美08月03日)