您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-09-04 10:42
血液融化设备为用于对临床血液成分进行解冻的设备。根据《医疗器械分类目录》,产品管理类别为二类,分类编码为10-01-06。本文仅适用于采用恒温水解冻原理的设备,微波炉法、射频法、干热空气法等原理的解冻设备不适用。
一、血液融化设备的结构组成
1.产品结构组成
该产品通常由加热水箱、解冻水箱、循环管路、控制部分等组成。根据解冻水箱中解冻槽(解冻夹、解冻篮)的不同可以分为水浴式和隔水式。水浴式为解冻过程中解冻血袋与水直接接触,隔水式为解冻过程中解冻血袋与水进行隔离,两者不直接接触。
不同生产企业的产品,在结构上存在一定差异,可以与本部分描述不完全一致,组成部分的名称也不限于文中描述。
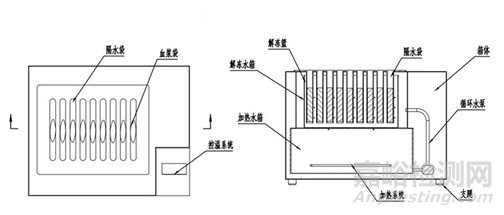
图1 血液融化设备结构示意图


图2 水浴式解冻槽示意图 图3 隔水式解冻槽示意图
2.产品工作原理
该产品通过提供恒温水流,实现对冰冻血液成分进行解冻。冰冻血浆在解冻过程中,若解冻水温过低,血袋受热不均匀,解冻时间过长,都可能会使纤维蛋白原激活转化为纤维蛋白,纤维蛋白可形成游离血栓,对患者造成伤害。而解冻水温过高,解冻时间过长等因素,则会使血浆中的凝血因子(特别是不稳定凝血因子,如V因子和VIII因子)活性减弱或丧失。
2.1加热水箱:实现将水加热到设定温度。开发人需要明确水箱的形式、材料、主要组成;明确加热方式,如加热膜、加热棒。有的产品可提供低于室温的恒定水流,此时应具降温部件,如压缩机等。
2.2解冻水箱:实现解冻水温与冰冻血袋的热交换。解冻水箱中有可拆卸的解冻槽,需明确解冻槽类型,如水浴式、隔水式;明确解冻槽的材料,解冻血袋的放置方式;明确实现解冻水温度均匀性的控制措施,如利用微型水泵等。有的产品还有摆动装置,使血袋在解冻过程中按照一定频率、幅度进行摆动,明确产品的摆动振幅、摆动频率。有的产品加热与解冻共用一个水箱,明确漏电流的防护措施。,开发人需明确产品对解冻用水的要求、更换周期、解冻水污染后的处理措施。
2.3循环管路:实现加热水箱与解冻水箱之间水的循环流动。开发人需明确循环泵的性能及水的循环路径,如循环泵的扬程、功率、水的流量等。
2.4控制部分:可实现对自动进排水,加热的启动、停止,解冻过程参数的设置、记录、显示、传输、异常提示等,可包括控制部件、电子存储部件、打印机等。开发人需明确具体的控制部件、控制方式,如编程逻辑控制器PLC、单片机控制等。
二、血液融化设备的主要风险
开发人应参照GB/T 42062《医疗器械风险管理对医疗器械的应用》中的规定,并结合产品本身的特点对产品风险进行全生命周期的管理,如产品的高温、高湿特性。风险管理活动要贯穿产品设计、生产、上市后使用及产品处理的整个生命周期。
表1中给出了产品常见的风险要素及示例。由于不同产品的工作原理、结构组成、性能指标存在差异,所以这些风险要素并不是全部,开发人还应根据产品特点确定其他风险并进行有效控制。
表1 产品常见的风险要素及示例
|
危险(源)分类 |
可能的原因 |
造成的后果 |
|
|---|---|---|---|
|
能量 危险 |
电磁能 |
设备受到电磁干扰 |
设备运行异常或不能工作 |
|
漏电流 |
操作人员接触到带电部分
|
操作者受到电击伤害 |
|
|
水锈腐蚀等原因造成加热管表面破损,输出漏电 |
操作者受到电击伤害 |
||
|
电介质强度 |
排水系统与加热系统之间的电气隔离不好 |
操作者受到电击伤害 |
|
|
热能 |
设备温度超出限定值,时间不到设定值 |
影响血液成分的融化效果 |
|
|
接触高温器件表面 |
人员烫伤 |
||
|
机械能 |
设备外壳粗糙、有毛刺 |
人员划伤 |
|
|
|
噪声 |
设备消音系统或运动部件损坏 |
人员不适 |
|
生物学危险 |
细菌感染 |
水箱消毒不彻底,温水中细菌滋生,污染血浆袋表面污染 |
操作者接触导致感染 |
|
血袋微渗漏或血袋破裂
|
血袋交叉污染,甚至无法使用 |
||
|
化学 危险 |
化学 残留 |
清洁或消毒残留物超标,刺激皮肤 |
对人体产生潜在的危害 |
|
信息 危险 |
标记 |
冷冻血袋融化时,与水接触,因潮湿、擦拭等造成标识模糊或脱落 |
产品相关信息不明 |
|
操作说明书 |
说明书未对故障排查作详细说明;说明书未对合理可预见的误用进行警告 |
非预期使用;设备不能正常工作;损坏设备;使用者受到电气伤害 |
|
|
操作 危险 |
使用 错误 未按照说明书中要求操作 |
在注册申请人规定的使用环境条件外使用产品 |
产品工作不正常 |
|
解冻水箱未按要求及时清洗消毒 |
滋生细菌,污染血袋 |
||
|
未使用纯化水或未定期更换解冻水 |
加热部件容易被水垢腐蚀;水泵易堵塞;水被污染 |
||
|
血袋破裂后未及时清洗管路 |
管路被腐蚀或损坏 |
||
三、血液融化设备的性能研究实验要求
1. 性能指标
1.1解冻性能
1.1.1最大解冻容量:在声称的工作方式下,最大的血袋数量。
1.1.2解冻时间
明确解冻时间和再升温时间,应符合规定。
再升温时间:设备预热完成后,加入最大数量冰冻血袋后,温度重新上升到设定解冻温度的时间。
解冻时间:设备预热完成后,从加入冰冻血袋到解冻完成时间。
1.1.3解冻温度
血浆:37℃;
冷沉淀凝血因子:37℃;
红细胞:37~40℃。
温度的均匀性、波动范围应符合申请人的规定。
1.2水位监控功能
应有水位监测装置,当水位低于要求时,应停止加热并发出异常提示。
1.3温度保护功能
应提供超温保护装置,该装置应在不超过最高设定温度+2℃动作,停止加热,并提供连续的听觉和视觉提示。
1.4显示功能
1.4.1设备应有实时温度显示,水位状态显示功能。
1.4.2明确温度的显示范围、示值误差。
1.5隔水功能(隔水式适用)
解冻过程中,解冻槽的隔水部件不应漏水。
1.6摆动功能(若适用)
摆动幅度、摆动频率应符合规定。
1.7清洗消毒功能
若产品具有清洗或消毒功能,应明确清洗流程,消毒方式、消毒参数。
1.8噪声
产品工作噪声应≤65dB(A)。
1.9软件及网络安全要求
应符合《医疗器械软件注册审查指导原则》《医疗器械网络安全注册审查指导原则》的要求,如软件的功能、使用限制、接口、访问控制、运行环境(若适用)、性能效率(若适用)等要求,且应与说明书中的功能描述一致。
1.10安全性能
电气安全应符合GB 4793.1、GB 4793.6的要求。
电磁兼容应符合GB/T 18268.1的要求。
1.11其他
产品具有的其他特定功能,应制定相应的指标。如二维码扫描功能等。
2、产品性能研究
开发人需明确适用的标准或方法。关于适用标准中的不适用条款,需要明确不适用的原因。如冷冻血液成分的解冻温度,可参照《血站技术操作规程(2019版)》《临床输血技术规范》的要求,并结合产品自身特点进行制定。
开发人可结合产品工作模式、结构特征等,开展相应的验证研究。如对产品声称冷冻血液成分的解冻容量、解冻温度、解冻时间、解冻终点、最大负载下的水温波动范围等,开展相应的研究。如产品若采用加热和解冻共用一个水箱,开发人应对漏电流的防护措施有效性进行验证,产品若采用隔水式解冻,开发人应验证产品水箱结构形式、隔水材料等对导热性能的影响,是否会延长解冻时间。产品若具有摆动功能,开发人应验证在最大振幅、最大频率下是否会对冰冻血袋的质量造成影响。开发人需验证产品最大解冻负载情况下,解冻用水更换周期合理性,解冻水污染后的处理措施有效性。
3、清洗消毒工艺研究
该产品为体外使用设备,为非无菌产品。开发人应明确消毒工艺(方法和参数)以及所推荐消毒方法确定的依据。要考虑血袋破损、解冻水污染等条件下,水箱、管路的清洗、消毒要求。若适用,建议说明不同消毒剂的消毒效果,开展相关研究。
4、稳定性研究
4.1使用稳定性
开发人可参考《有源医疗器械使用期限注册技术审查指导原则》,开展产品使用期限的研究。开发人应充分考虑产品高温、高湿的工作特性。
若含有高分子材料的隔水部件,开发人应开展使用次数及时间的验证研究。
4.2运输稳定性
开发人需开展运输稳定性和包装研究。应结合运输条件开展包装和运输试验研究,证明运输过程中的工作条件不会对医疗器械造成不利影响。
可参照GB/T 14710等相关标准,开展产品环境试验的研究。应结合声称的工作条件开展环境试验研究,并明确研究设置的合理性。证明在测试后,产品的性能、功能满足使用要求。
5、软件及网络安全研究
开发人可以依据《医疗器械软件注册审查指导原则》,开展软件研究。软件研究需覆盖全部软件组件。其软件安全性级别定义为中等(B级)。
开发人需明确软件完整版本的全部字段和字段含义,并确定软件完整版本和发布版本。
开发人可以参照《医疗器械网络安全注册审查指导原则》开展网络安全研究。
6、其他研究
根据产品的具体特性,需的其他研究,如产品具有的清洗消毒功能等。
7.其他
血液融化设备、冰冻血浆解冻箱属于列入《免于临床评价医疗器械目录》中的产品,开发人应按照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》,从基本原理、结构组成、性能要求、预期用途等方面,证明产品的安全有效性。若经对比,存在其他差异的,还应开展差异部分对安全有效性影响的分析研究。
表2 血液融化设备、冰冻血浆解冻箱免于临床评价描述
|
10-01-06 |
血液融化设备 |
通常由加热水箱、解冻槽、循环管路、进水管、排水管、控制箱组成,临床用于血浆或血液的加热、解冻。 |
Ⅱ |
|
10-01-06 |
冰冻血浆解冻箱 |
冰冻血浆解冻箱由加热水箱、解冻槽、循环管路、进水管、排水管、电器控制箱等组成,可具有报警等功能,可按结构组成、最大化浆量、解冻时间等技术参数、附加功能等不同分为若干型号,用于对临床血浆进行加热、解冻。 |
Ⅱ |

来源:嘉峪检测网


