您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2023-11-24 13:06

|
序号 |
标准编号 |
标准名称 |
制修订 |
替代标准 |
适用范围 |
实施日期 |
|---|---|---|---|---|---|---|
|
1 |
YY 0315—2023 |
钛及钛合金牙种植体 |
修订 |
YY 0315—2016 |
本文件规定了以锻制钛及钛合金材料制成的不带表面涂层的牙种植体的性能要求、包装、标识和使用说明书,并描述了相应的试验方法。本文件适用于由化学成分符合GB/T 13810或ISO 5832-2、ISO 5832-3、ISO 5832-11或ASTM F67、ASTM F136、ASTM F1295、ASTM F1472中外科植入物用钛及钛合金材料制成的牙种植体。本文件不适用于牙种植体附件和增材制造钛及钛合金牙种植体。 |
2026年12月1日 |
|
2 |
YY 0469—2023 |
医用外科口罩 |
修订 |
YY 0469—2011 |
本文件规定了医用外科口罩的技术要求、试验方法、标志、包装、运输和贮存。本文件适用于医护人员在含有潜在血液、体液、分泌物污染风险的医疗环境及有创操作环境佩戴的一次性医用口罩。本文件不适用于医用及其它工作环境下的防护口罩。 |
2026年12月1日 |
|
3 |
YY 0793.2—2023 |
血液透析和相关治疗用液体的制备和质量管理第2部分:血液透析和相关治疗用水 |
修订 |
YY 0572—2015 |
本文件规定了制备透析浓缩液、透析用液体(用于血液透析、血液透析滤过或血液滤过)所用水的最低要求。本文件适用于制备透析浓缩液、透析用液体(用于血液透析、血液透析滤过或血液滤过)所用水。本文件不涉及水处理设备的使用,及水经处理后与浓缩物混合制成最终透析液的操作。这些操作由透析专业人员负责。本文件不适用于透析液再生系统。 |
2026年12月1日 |
|
4 |
YY 1042—2023 |
牙科学聚合物基修复材料 |
修订 |
YY 1042—2011 |
本文件规定了牙科聚合物基修复材料的要求。该类材料是以适合于经机械混合、手工调和、或在口腔内和口腔外采用外部能量激活的形式提供的,主要用于牙齿的直接或间接修复和粘固。本文件所涵盖的聚合物基粘固材料是指用于修复体和修复装置,如嵌体、高嵌体、贴面、冠和桥的粘固或固位的材料。本文件不涵盖材料中含有粘接性成分的聚合物基粘固材料(见ISO/TS 16506)。本文件不涵盖用于预防龋齿的牙科聚合物基材料(见YY 0622)、桩核材料或用于金属基底上的贴面材料(见YY 0710)。 |
2026年12月1日 |
|
5 |
YY/T 0003—2023 |
手动病床 |
修订 |
YY/T 0003—1990 |
本文件规定了手动病床的要求、试验方法和说明书。本文件适用于手动病床。该产品预期用于身高等于或大于146cm,质量等于或大于40kg,体重指数(BMI)等于或大于17的患者。 |
2025年12月1日 |
|
6 |
YY/T 0127.4—2023 |
口腔医疗器械生物学评价第4部分:骨植入试验 |
修订 |
YY/T 0127.4—2009 |
本文件描述了口腔医疗器械的骨植入试验方法。本文件适用于评价组织对拟长期或持久与口腔骨组织接触的口腔医疗器械的生物学反应。 |
2024年12月1日 |
|
7 |
YY/T 0127.19—2023 |
口腔医疗器械生物学评价第19部分:亚急性和亚慢性全身毒性试验:植入途径 |
制定 |
/ |
本文件描述了口腔医疗器械亚急性和亚慢性植入途径的全身毒性试验方法。本文件适用于评价口腔医疗器械植入途径的亚急性和亚慢性全身毒性试验。 |
2024年12月1日 |
|
8 |
YY/T 0489—2023 |
一次性使用无菌引流导管及辅助器械 |
修订 |
YY/T 0489—2004 |
本文件规定了一次性使用无菌的引流导管、伤口和积液引流系统、手术引流导管和有关组件的要求,其中导管以手术或经皮方式放置于体腔或伤口中,用于将液体或空气引流到体外。引流导管留作自然引流或连接至吸引源(以加快组织肉芽形成)。本文件不适用于:抽吸导管;气管导管;导尿管;输尿管支架、胆道支架和其他支架;采用胃造口术经皮置入消化道的引流管;用于去除脑脊液的轴索导管;用于从胃肠道中去除溶液或物质的肠导管;涂层。 |
2024年12月1日 |
|
9 |
YY/T 0929.3—2023 |
输液用药液过滤器第3部分:标称孔径0.22μm药液过滤器液体细菌截留试验方法 |
修订 |
YY/T 0918—2014 |
本文件描述了评价标称孔径0.22 μm输液用药液过滤器液体细菌截留能力的试验方法。本文件适用于标称孔径0.22 μm输液用药液过滤器液体细菌截留能力的评价,输液用药液过滤膜材液体细菌截留能力的评价可参考本文件。本文件不适用于0.22 μm输液用药液过滤器对特定种类药品细菌截留能力的验证。该验证宜采用特定药液或替代溶液在模拟实际临床输液条件下进行。 |
2024年12月1日 |
|
10 |
YY/T 0969—2023 |
一次性使用医用口罩 |
修订 |
YY/T 0969—2013 |
本文件规定了一次性使用医用口罩的技术要求、试验方法、标志、包装、运输和贮存。本文件适用于覆盖使用者口、鼻及下颌,用于普通医疗环境中佩戴、阻隔口腔和鼻腔呼出或喷出污染物的一次性使用口罩。本文件不适用于医用防护口罩、医用外科口罩。 |
2025年12月1日 |
|
11 |
YY/T 1842.3—2023 |
医疗器械医用贮液容器输送系统用连接件第3部分:胃肠道应用 |
制定 |
/ |
本文件规定了预期用于胃肠道贮液容器连接件的尺寸及设计与功能特性的要求。本文件未规定使用这些连接件的医疗器械或附件的尺寸或性能要求。这些要求在专用的医疗器械或附件的标准中给出。本文件不适用于螺纹盖、皇冠盖以及螺口,因为它们不是医疗器械专用的连接件。尽管胃肠道给养器经常需要与其连接,但他们更适用于食品和饮料包装的领域。 |
2024年12月1日 |
|
12 |
YY/T 1904—2023 |
医用防护眼 (面)罩 |
制定 |
/ |
本文件规定了医用防护眼罩和医用防护面罩的要求、试验方法、标志、包装、运输和贮存。本文件适用于在医疗工作环境下佩戴,防止患者血液、体液、分泌物等直接溅入眼、面部引起感染的一次性使用的医用防护眼罩、医用隔离眼罩(以下简称眼罩)和医用防护面罩、医用隔离面罩(以下简称面罩)。本文件不适用于非医用及其他医疗用途的眼罩和面罩。 |
2025年12月1日 |
|
13 |
YY/T 1928—2023 |
预期用于磁共振环境的医用电气设备的术语和 分类 |
制定 |
/ |
本文件界定了预期用于磁共振环境的医用电气设备的术语,规定了预期用于磁共振环境的医用电器设备的分类。本文件适用于在磁共振环境中使用的医用电气设备。 |
2024年12月1日 |
|
形式 |
状态 |
厚度或直径 d/mm |
抗拉强度 Rm/MPa |
规定非比例 延伸强度 Rp0.2/MPa |
断后伸长率 A/(%) |
|
板材和 带材 |
冷加工 |
0.13≤d≤0.26 |
≥520 |
≥345 |
—— |
|
>0.26 |
≥2 |
|
形式 |
状态 |
厚度或直径 d/mm |
抗拉强度 Rm/MPa |
规定非比例 延伸强度 Rp0.2/MPa |
断后伸长率 A/(%) |
|
板材和 带材 |
冷加工 |
≥0.13 |
≥520 |
≥345 |
≥2 |
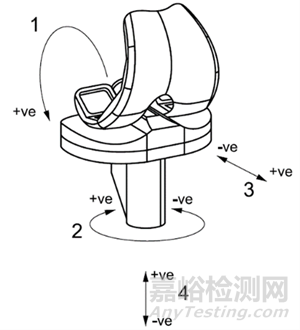
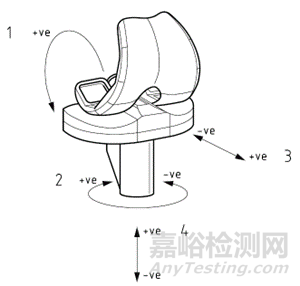
(自发布之日起实施)
一、封面
“(ISO 14243-2:2009,IDT)”
修改为:
“(ISO 14243-2:2016,MOD)”
二、前言
“本部分使用翻译法等同采用ISO 14243-2:2009《外科植入物全膝关节假体的磨损第2部分:测量方法》
与本部分中规范性引用的国际文件有一致性对应关系的我国文件如下:
——YY/T 1426.1—2016 外科植入物全膝关节假体的磨损第1部分载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件(ISO 14243-1:2009,IDT)。”
修改为:
“本部分修改采用ISO 14243-2:2016《外科植人物全膝关节假体的磨损第2部分:测量方法》
与ISO 14243-2:2016相比,主要技术变化如下:
——关于规范性引用文件,本文件做了具有技术性差异的调整,以适应我国的技术条件,提高可操作性,具体调整如下:
•用等同采用国际标准的YY/T 1426.1代替了ISO 14243-1;
•用等同采用国际标准的YY/T 1426.3代替了ISO 14243-3。”
三、第1章中
“YY/T 1426的本部分规定了按第1部分进行全膝关节假体磨损试验后利用重量分析法评估全膝关节假体胫骨部件磨损的方法。”
修改为:
“YY/T 1426的本部分规定了按第1部分或第3部分进行全膝关节假体磨损试验后利用重量分析法评估全膝关节假体胫骨部件磨损的方法。”
四、第2章中
“ISO 14243-1 外科植入物全膝关节假体的磨损第1部分:载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件(Implants for surgery — Wear of total knee-joint prostheses — Part 1: Loading and displacement parameters for wear-testing machines with load control and corresponding environmental conditions for tests)”
修改为:
“YY/T 1426.1外科植入物全膝关节假体的磨损第1部分:载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件(YY/T 1426.1—2016及1号修改单,ISO 14243-1: 2009&AMD 1:2020,IDT)”
增加:
“YY/T 1426.3 外科植入物全膝关节假体的磨损第3部分:位移控制的磨损试验机的载荷和位移参数及相关的试验环境条件(YY/T 1426.3—2017及1号修改单,ISO/ 14243- 3:2014&AMD 1:2020,IDT)”
五、4.2.1中
“液体试验介质,按ISO 14243-1规定。”
修改为:
“液体试验介质,视情况按YY/T 1426.1或YY/T 1426.3的规定。”
六、4.2.2
删除本条款。
七、4.4.1中
“试验样品,符合ISO 14243-1。”
修改为:
“试验样品,符合YY/T 1426.1或YY/T 1426.3。”
八、4.4.2中
“对照样品,符合ISO 14243-1。”
修改为:
“对照样品,符合YY/T 1426.1或YY/T 1426.3。”
九、4.6.1中
“在试验机上安装样品,并根据ISO 14243-1进行磨损试验。”
修改为:
“在试验机上安装样品,并按照YY/T 1426.1或YY/T 1426.3进行磨损试验。”
十、第5章中
“f)引用ISO 14243-1规定的磨损试验方法;”
修改为:
“ f)引用YY/T 1426.1或YY/T 1426.3规定的磨损试验方法;”
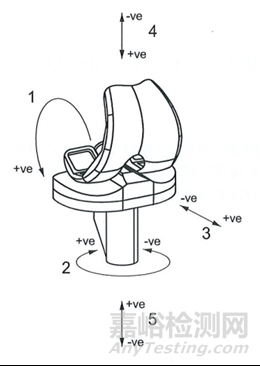
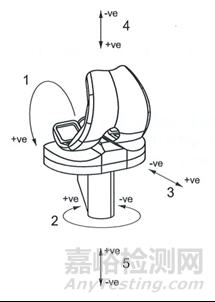
(自发布之日起实施)
一、封面
“(ISO 23317:2012,IDT)”
修改为:
“(ISO 23317:2014,IDT)”
二、前言
“本标准使用翻译法等同采用ISO 23317:2012《外科植入物植入材料磷灰石形成能力的体外评估》。”
修改为:
“本标准使用翻译法等同采用ISO 23317:2014《外科植入物植入材料磷灰石形成能力的体外评估》。”
三、7.3中:
“在极少数情况下,磷灰石既会在SBF溶液中均匀析出,也会沉积在样品表面。”
修改为:
“纯净、新鲜制备、无尘的SBF溶液在透明瓶中加热至37℃持续4周,即使没有任何测试样品浸入其中,溶液仍会析出磷灰石。如果碰巧有一个试样浸入该溶液中,那么将会有溶液析出物沉积在试样的表面。”

来源:国家药监局


