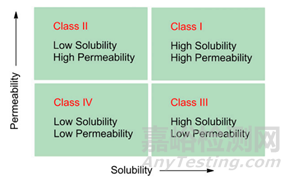
a.BCS分类系统
生物利用度(Bioavailability BA)是反映药物活性成分吸收进入体内的程度和速度的指标。为了仿制药质量和疗效一致性评价中口服固体常释制剂申请生物等效性(Bioequivalence)豁免,提出了生物药剂学分类系统,即BCS分类系统,重点强调了药物的溶解性和渗透性在药物吸收过程中的重要作用。指导原则中重点强调了化合物在pH1.0—6.8范围内的水溶性介质中溶解情况,如若单次给药的最高剂量在上述pH范围内可完全溶解于250ml介质,表明化合物具有高溶解性;当一个口服药物采用质量平衡测定的结果或是相对于静脉注射的参照剂量,显示在体内的吸收程度≥85%以上(并且有证据证明药物在胃肠道稳定性良好),则可说明该药物具有高渗透性。除了上述应用,BCS分类系统在制药行业也被广泛应用于在早期处方开发中对候选化合物进行分类,因为BCS还提供了一个框架来考虑可能影响体内性能的关键因素(剂量、溶解度、渗透性和溶出)。这些因素的重要性比确定适合生物豁免的药物产品更广泛,因为它们通过推断还定义了决定体内性能的关键质量属性(CQA)。
图1.BCS分类系统图示,根据药物的渗透性和溶解性对药物进行分类。当存在于最高浓度速释制剂中的药物量在胃肠道pH值(1.2-7.5)的可能范围内可溶于250毫升水中时,化合物被定义为高溶解性。高渗透性化合物定义为吸收率为>90%或通过体外或体内方法评估的渗透性等于或高于吸收率为90%的参考化合物的化合物。(来源于参考文献1)
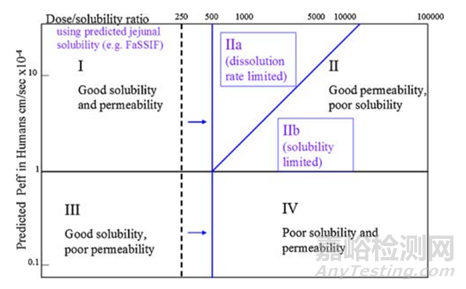
b.改良版本BCS分类系统-DCS分类系统
因为溶出度试验的重要应用是预测固体口服固体制剂的体内性能。然而,通常用于质量控制溶出度试验的简单缓冲水溶液并不代表胃肠道(GI)生理状况的所有方面,通常最多只能提供与体内数据的经验相关性。预测近肠端管腔内性能通常需要充分模拟胃和小肠近端区域的条件。所以溶解度测试不仅考虑药物在水中的溶解度,还考虑在生物相关介质中的溶解度,例如禁食状态模拟肠液(FaSSIF)和使用含有胆盐和卵磷脂粉末的相应进食状态模拟介质(FeSSIF)。这种基于生物相关溶解度可以进一步改良BCS分类系统,这对药物发现和早期制剂供应有意义。获得空肠溶解度的估计值很重要,因为在小肠上部,药物溶解的液体体积达到最大值,并且这也是大多数速释药物被吸收的地方。人类空腹肠道溶解度的估计值(例如,通过使用FaSSIF)作为体内溶解度的主要衡量标准,可用于预测范围人体吸收。
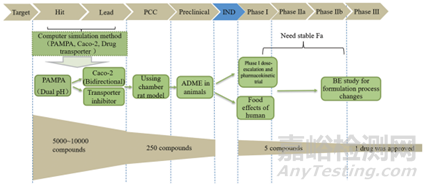
为了在开发的早期阶段对药物进行分类,不仅改良了FDA对于溶解度的定义,而且还改良了对于渗透性的定义。我们可以看到很多公司使用基于例如Caco-2细胞通透性或甚至肠通透性的物理化学药物预测因子来预测药物吸收限制。在新药研究的不同阶段,可以采用不同的研究方法获知药物渗透性信息,以提高新药开发效率,推进新药向前。新药不同研究阶段,常用渗透性预测方法见图2。在新药的药物开发过程中,可以通过多种技术来评估渗透性。尽管根据BCS定义的吸收分数在高渗透率和低渗透率之间使用截断是可能且合理的,但挑战在于找到与吸收分数具有足够相关性的合适渗透率测量,且执行简单。文献中报道的方法包括基于计算机药物特性的那些方法,例如logD和氢键势,被动扩散穿过人工膜,体外细胞系渗透性,穿过切除的人类或动物组织和通过原位灌注技术确定的渗透性。在产品开发的早期阶段和用于评估候选药物时,首选更简单的方法,而在后期开发中可能会执行更复杂的测量。对于正式的BCS分类,在使用的方法和方法验证方面,关于什么是可接受的渗透率评估方法有具体的指导。
图2.新药发现和开发不同阶段的体外渗透性模型。PCC:临床前候选化合物;IND:研究性新药申请;ADME:吸收、分布、代谢和消除;PK:药代动力学;BE:生物等效性(来源于参考文献3)
图3改良版本BCS分类系统,即DCS分类系统(来源于参考文献4)
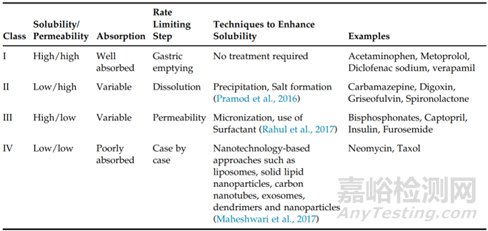
根据化合物BSC分类系统所属类别,可以根据类别分配不同的资源和开发时间表。如果分子表现出高溶解性和渗透性(即BCSⅠ类),则更简单的PIB或PIC制剂方法通常满足化合物临床试验。其他药物类别通常需要更严格的处方,尤其是BCSIV(低溶解性和低渗透性)化合物,可能需要其他制剂开发策略,具体策略见图4。
图4基于BCS分类系统可采取的制剂开发策略(来源于参考文献5)
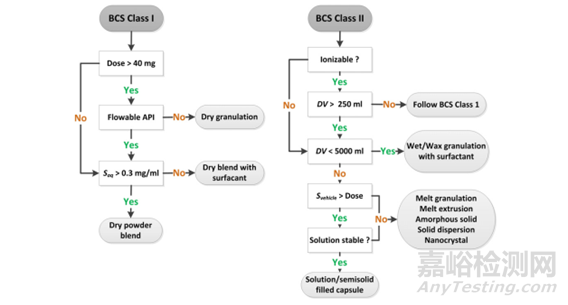
图5基于BCSⅠ/Ⅱ类分类药物制剂开发策略(来源于参考文献1)
对于每种制剂方法,都有几种工艺技术可用于制造药物产品。关于如何从战略上进行,当然需要指导,一个好的起点确实是BCS分类系统(图5)。当化合物水溶性看起来相当没有问题,即>0.3mg/ml时,根据剂量和流动特性,将BCSI化合物物配制成简单的粉末混合物。如果不满足溶解度标准,则用表面活性剂配制干混合物。在流动性问题的情况下,优选使用压辊压实(RC)将药物制粒。
图5进一步表明,给定的BCSII药物将使用离子化标准进行初步评估。剂量体积DV是通过将人体剂量除以弱碱性化合物在pH6下的溶解度或弱酸性或中性化合物在pH5下的溶解度来计算的。DV≤250ml的可电离药物按BCSI标准处理。对于较高的DV值(但仍低于5000ml),建议使用含表面活性剂的湿法或wax制粒。表现出最高DV值(>5000ml)的化合物肯定更难配制。如果基于脂质的载体能够为预期剂量提供足够的溶解度和稳定性,则考虑将液体填充到胶囊中。其他具有高DV的药物很难溶解在广泛的辅料及其混合物中。当药物在载体中的溶解度Svehicle不能以胶囊的典型体积溶解剂量时,则需要其他替代制剂。这些药物被提议用于无定形固体分散体ASD(例如通过熔融挤出)或纳米晶体制剂。最后,BCSIII和IV药物需要来自大鼠灌注研究或Caco-2实验的估计,以获得相应的决策树。使用美托洛尔作为参考考虑相对有效渗透率值。如果药物的有效渗透性低于该参考值的5%,则推荐口服以外的给药途径。然而,相对渗透率值在5%和50%之间的候选药物是使用促渗剂制备的。具有大于50%的相对渗透性的BCSIV化合物被像BCSII药物一样处理。在低于该渗透极限的情况下,只有当溶液(含促渗剂)可以在胶囊中稳定时,才建议口服BCSIV化合物。关于公司如何制定自己筛选战略,这项开创性的工作需要在理论与实践中不断地摸索。
改良版本的BCS分类系统,即“可开发性分类系统”(DCS),其考虑了生物相关的溶解度(在FaSSIF中)以及以目标药物粒度表示的溶出速率。此外,在DCS中使用了溶解度限制可吸收剂量(SLAD),这改变了先前报道的最大可吸收剂量的概念。生物相关溶解度通常高于相应的水溶液值,并且考虑增加胃肠液体积(500ml)用于药物溶解。因此,BCS的溶解度分界线在DCS中被转移到更高的极限,以区分药物类别。可开发性系统根据药物吸收的溶出限制(IIa)或溶解度极限(IIb)进一步区分II类化合物。这种定义对于处方的选择是有意义的。尽管DCS已被引入作为一种可开发性评估工具,具有一定溶出限制的BCSII化合物可以用基于颗粒尺寸减小、湿法制粒和/或添加表面活性剂的相当简单的处方来开发。然而,DCSIIb类别中的其他BCSII化合物可能需要使能处方,例如LBF或ASD。似乎,为了选择基于生物药剂学分类系统的早期处方策略,DCS提供了一个比BCS更详细的开发方向。
参考文献
1.Strategies to Address Low Drug Solubility in Discovery and Development
2.人体生物等效性试验豁免指导原则
3.药物通透性在新药发现和开发阶段的评估策略
4.The developability classification system: application of biopharmaceutics concepts to formulation development。
5.Physicochemical,Pharmaceutical,and Biological Considerations in GIT Absorption of Drugs
6.Methodology of oral formulation selection in the pharmaceutical industry。
7.化学药物制剂人体生物利用度和生物等效性研究技术指导原则
8.Dissolution media simulating conditions in the proximal human gastro intestinal tract: an update.