今日头条
齐鲁ALK/ROS1抑制剂肺癌III期临床见刊。齐鲁制药新型口服ALK/ROS1抑制剂伊鲁阿克(WX-0593)在《胸部肿瘤学杂志》上公布一线治疗局部晚期或转移性ALK阳性、非小细胞肺癌(NSCLC)的III期INSPIRE研究积极结果。IRC评估的结果显示,与克唑替尼相比,WX-0593显著提高患者无进展生存期(中位PFS:27.7个月vs14.6个月),使疾病进展或者死亡风险降低了66%。两组重度不良反应的发生率相当(51.7%vs49.7%)。
国内药讯
1.恒瑞「他克莫司缓释胶囊」获FDA批准上市。恒瑞医药宣布「他克莫司缓释胶囊」的简略新药申请(ANDA)已获得FDA批准。他克莫司是一种强效的免疫抑制剂,能够抑制造成移植排斥反应之细胞毒淋巴细胞的生成、T细胞活化及T辅助细胞依赖型B细胞的增殖、淋巴因子的生成(如白细胞介素2、白细胞介素3及γ干扰素)以及白细胞介素2受体的表达。该产品原研产品由安斯泰来开发,美国商品名为Astagraf XL。
2.亘喜双靶点FasTCAR-T获批新临床。亘喜生物靶向BCMA/CD19双靶点自体FasTCAR-T产品GC012F获FDA临床许可,即将在美国开展早线治疗多发性骨髓瘤(ELMM)Ⅰ期临床。去年2月和11月,FDA已批准GC012F在美国针对复发/难治性多发性骨髓瘤(R/R MM)和难治性系统性红斑狼疮(SLE)开展Ⅰ/Ⅱ期临床试验。在治疗R/R MM的临床试验(IIT)中,GC012F的总体应答率(ORR)达到100%。
3.恒瑞PD-L1+CTLA-4单抗联合用药获批临床。恒瑞医药PD-L1单抗阿得贝利单抗注射液获国家药监局临床试验默示许可,拟联合CTLA-4单抗SHR-8068及含铂双药用于携带丝氨酸-苏氨酸激酶11(STK11)基因突变,或Kelch样环氧氯丙烷相关蛋白1(KEAP1)基因突变,或鼠类肉瘤病毒癌基因(KRAS)突变的晚期或转移性非鳞状非小细胞肺癌患者的一线治疗。
4.浙江普洛终止索法地尔脑卒中III期临床。普洛药业宣布终止其1类化药注射用索法地尔治疗急性缺血性脑卒中的III期临床试验。临床试验终止后,已入组的受试者将继续按照临床试验方案进行随访。2009年,普洛药业旗下家园药业通过韩国Neurotech(GNT Pharma)授权,获得该产品在大中华区的自主知识产权。截至目前,索法地尔研发投入共计1.22亿元(未经审计)。
5.疫苗研发公司康乐卫士申请港交所IPO。1月29日,康乐卫士在港交所递交IPO申请并获得受理。招股书显示,该公司拥有丰富的HPV疫苗产品组合。核心产品三价HPV疫苗将于2024年递交上市申请,九价HPV疫苗将于2025年递交上市申请,十五价HPV疫苗将于2024年启动Ⅰ期临床。康乐卫士还正在开发RSV疫苗、带状疱疹疫苗、七价诺如病毒疫苗、HFMD疫苗、脊髓灰质炎疫苗和二价治疗性HPV疫苗。
国际药讯
1.FDA发布基因编辑疗法和CAR-T开发指南。FDA日前针对使用基因组编辑的基因疗法和体外制造的CAR-T产品发布最终行业指南。FDA支持对基因组编辑产品使用加速批准通道,并鼓励开发商尽早讨论在研产品使用这一途径的可能性,包括在临床开发早期进行讨论,提供替代终点或中间临床终点。CAR-T开发指南除了提供关于CMC、药理学和毒理学以及临床试验设计的具体建议外,还新增了对癌症适应症的关注。
2.Celltrion托珠单抗生物类似药在美报BLA。Celltrion旗下Celltrion USA公司开发的托珠单抗生物类似药CT-P47已向FDA递交生物制品许可申请(BLA)。托珠单抗原研产品(商品名:Actemra)是罗氏子公司中外制药开发的一款抗白介素-6受体(IL-6R)单抗,目前已获批用于治疗类风湿关节炎、活动性多关节幼年特发性关节炎、巨细胞动脉炎、细胞因子释放综合征、系统性硬化症相关间质性肺疾病(SSc-ILD)和新型冠状病毒感染等6项适应症。
3.K药辅助治疗肾癌最新III期临床积极。默沙东PD-1抑制剂Keytruda辅助治疗肾切除术后或肾切除术联合转移灶切除术后有中高/高复发风险的肾细胞癌(RCC)患者的III期KEYNOTE-564研究结果积极。中位随访为57.2个月时,K药辅助治疗可使疾病复发或死亡风险降低28%(HR=0.72 [95% CI, 0.59-0.87]);显著改善患者总生存期,死亡风险降低38%;研究中未出现新的安全性信号。
4.Locus公司CRISPR噬菌体疗法上Ⅱ/Ⅲ期临床。Locus公司宣布获得美国生物医学高级研究与发展管理局(BARDA)2390万美元资助,将启动一项Ⅱ/Ⅲ期临床试验,评估CRISPR增强型噬菌体疗法LBP-EC01用于治疗由耐药性大肠杆菌引起的尿路感染(UTIs)患者的潜力。LBP-EC01具有独特的双重作用机制:噬菌体的天然裂解活性和CRISPR-Cas3的DNA靶向活性。该产品在杀死致病菌的同时保留有益细菌。
5.体内RNA编辑疗法获批眼科Ⅰ/Ⅱ期临床。Ascidian公司RNA外显子编辑疗法ACDN-01获FDA批准开展Ⅰ/Ⅱ期临床STELLAR,评估一次性经视网膜下注射ACDN-01在患有Stargardt病和其他ABCA4相关视网膜病变的受试者中的安全性与初步疗效。Stargardt病是由ABCA4基因变异导致的一种遗传性黄斑变性。ACDN-01能够重新编辑RNA序列,将导致疾病的RNA序列替换为功能正常的RNA序列。
6.吉利德与Arcus公司修订合作协议。吉利德宣布修订与Arcus公司的合作协议,并向Arcus公司追加3.2亿美元投资,将持股比例提高至33%。根据修订协议,两家公司重新确定了TIGIT抗体多凡纳利单抗(Domvanalimab)联合开发项目的优先次序,专注于推进并可能加速STAR-121(肺癌)和STAR-221(胃肠道癌)的Ⅲ期研究;注册启动一项Ⅲ期肺癌研究STAR-131(包括domvanalimab和PD-1抗体zimberelimab方案)。2020年,吉利德已与Arcus达成为期10年的合作。
医药热点
1.马斯克称已完成首例人类大脑设备植入手术。当地时间29日,马斯克在社交媒体上表示,其脑机接口公司Neuralink已完成首例人类大脑设备植入手术,接入者“恢复良好”。Neuralink公司的首款产品被命名为Telepathy(心灵感应)。马斯克表示,“只需要思考,就可以控制手机或电脑,并通过它们控制几乎任何设备”。首批使用者将是失去肢体功能的人。
2.山东省立医院临床心理科成立。1月26日,山东第一医科大学附属省立医院(山东省立医院)临床心理科正式揭牌成立。临床心理学科在心理咨询门诊的基础上增设了病房服务。临床心理科病房的成立将助力增强专业科室的临床诊疗和科研教学水平,进一步提升医院综合服务能力和水平。
3.去年跨省异地就医直接结算1.29亿人次。国家医保局29日公布2023年全国医疗保障跨省异地就医直接结算公共服务信息,信息显示,2023年1—12月,跨省异地就医直接结算运行基本平稳,跨省异地就医直接结算1.29亿人次,减少参保群众垫付1536.74亿元,分别较2022年增长238.67%、89.91%。截至2023年12月底,全国住院费用跨省联网定点医疗机构达8.23万家,较2022年底增加1.96万家。2023年1—12月,全国住院费用跨省直接结算1125.48万人次,减少个人垫付1351.26亿元,分别较2022年增长97.87%、77.25%。
评审动态
1. CDE新药受理情况(01月30日)
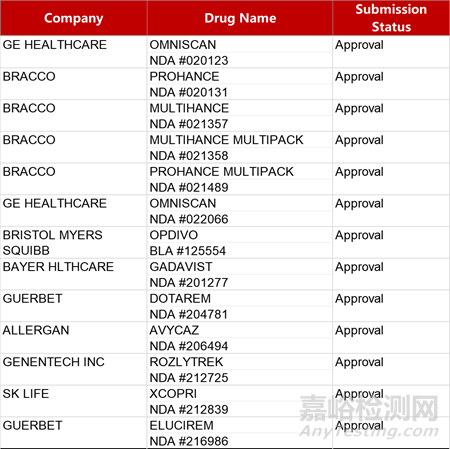
2. FDA新药获批情况(北美01月29日)