您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2024-05-14 08:47
近日,强生子公司爱惜康 (Ethicon) 的Megadyne部门决定从全球市场上召回一款儿科电外科电极垫,并停止生产该款设备。
FDA将其定为一级召回,存在患者严重烧伤或死亡的风险,涉及设备21,200台。从2018年至今,有4起与该产品相关的受伤报告,没有死亡报告。
召回详细信息
据悉,召回原因是:Megadyne收到了在使用该产品时患者烧伤报告,于是对报告的根本原因进行调查,结果显示多种因素共同存在可能会导致患者的热损伤。
MEGA SOFT 电外科电极垫是一种用于手术室的电外科设备,它主要用于电外科手术中作为负极板使用,可以用于手术、腹腔镜等多种手术场景。
MEGA SOFT兼容大多数主流隔离电刀发生器,该产品的设计旨在防止电流过度集中,减少热量积聚,从而最大限度地减小手术垫部位烧伤的可能性。

MEGA SOFT 可重复使用患者电极
该产品可重复使用长达24个月,在很大程度上减少医疗废弃物的产生。此外,其采用无胶设计,消除了与胶带相关的患者伤害,并且不含乳胶,提高了患者的保护性。
此次召回通知发出后,FDA提示用户应停止使用并将其退回。Megadyne正在通过邮件通知全球客户和经销商,开始自愿召回所有MEGA SOFT儿科患者回流电极。
细数强生近期的多次召回
其实这并非Megadyne第一次召回该产品。早在2024年1月,FDA因患者烧伤问题召回Mega Soft通用患者回流电极垫,并将其召回级别定义为一级。

召回型号:0845,0846,0847,0848;
召回数量:9,428台
召回原因:为了限制12岁及以下患者使用该设备,Megadyne医疗产品公司正在召回Mega Soft通用患者回流电极系列产品,以更新使用说明和产品标签。
Megadyne收到了包括需要干预的三度烧伤在内的患者烧伤报告。对于儿童和成人患者,烧伤可能导致延长住院时间、留下疤痕以及需要额外的手术。特别是对12岁以下的患者,严重的烧伤可能会对患者造成潜在的长期影响。
回顾近一年多,强生公司面临的FDA一级召回不在少数,思宇列举部分如下:
2024年3月1日,FDA发布强生公司旗下Megadyne 儿科患者回流电极产品 I 类召回。

2024年1月9日,FDA宣布了一项针对强生公司旗下Megadyne部门的紧急医疗器械更正通告,并将其定为一级召回。

2023年7月21日,FDA将强生医疗公司旗下的电外科工具召回事件定级为I类召回,相关设备存在可能导致严重伤害甚至死亡的风险。

根据FDA的报告,该系列电外科工具的使用已导致63人遭受烧伤,需要住院治疗,并且很可能会留下永久性疤痕。
了解电外科市场
作为应用于外科手术室的高频电流手术系统,电外科集众多外科高频电流手术设备于一体。
常见的电外科设备有单极电刀、双极电凝、超声刀、回路负极板等。
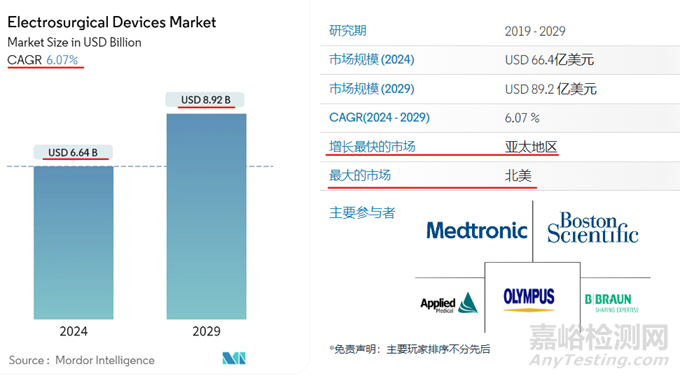
根据多份报告,全球电外科产品市场2024年市场规模将达到66.4亿美元,2029年将增长至89.2亿美元,复合年增长率为 6.07%。
市场领导者包括Applied Medical Resources Corporation、美敦力、奥林巴斯、波士顿科学和贝朗医疗等。
其中,2023年4月,Innoblative Designs 的 SIRA RFA 电外科设备 (SIRA) 获得FDA突破性设备认定,用于治疗接受肿瘤切除术的乳腺癌患者。相关阅读:FDA突破性设备认定!乳腺癌消融

2023年6月,奥林巴斯推出 ESG 410高频电刀,适用于开放式、腹腔镜和内窥镜手术。有单极和双极2种模式,即插即用。

关于 Megadyne
Megadyne是一家成立于1985年的医疗器械公司,总部位于美国,专注于设计、制造和销售用于电外科手术的医疗器械和工具。
2017年1月20日,强生集团旗下子公司爱惜康发文宣布,成功完成对Megadyne Medical的收购。
Megadyne 的产品组合,包括单极和双极电极、患者返程电极、发生器和烟雾排除系统,为爱惜康的提供了补充。
除了电极垫片之外,Megadyne还研发了E-Z Clean电凝刀片。
E-Z Clean电凝刀片具有独特的非粘性聚四氟乙烯(PTFE)涂层,在手术中外科医生仅需使用海绵或无菌纱布垫,就可以轻松清除任何痂皮积聚或碎片。

目前,MEGADYNE已经开发了一整套各种尺寸、形状和配置的电凝刀片,以适应各种手术需求。其中包括标准刀片电极、消毒剂刀片电极、精密刀片电极等,以及一系列可用于腹腔镜手术的一次性电极。

来源:Internet


