您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-21 08:33
一、试验数据保护制度
试验数据保护制度是一种旨在保护药品创新的法律制度,它允许原研药公司在一定期限内对其药品试验数据享有独占权。这一制度的设立是为了鼓励药品创新,促进医药行业的正向发展,同时保护原研药企的权益。试验数据保护制度的本质是市场独占期,在此期间,仿制药/生物类似药不予批准上市。
目前,美国、欧盟、日本、加拿大等国家的试验数据保护制度已运行较长时间,积累了丰富经验。而我国自02年起设立相关制度,但一直未得到有效落实。
二、美国试验数据保护制度
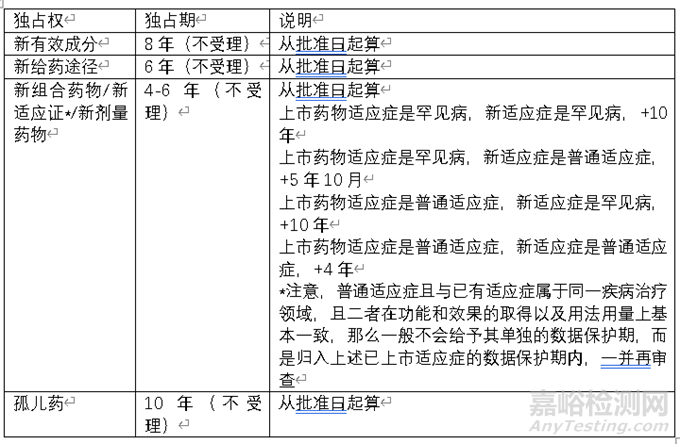
美国试验数据保护制度开始于1987年,规定了化学药的独占期。在 2009年BPCI 法案,扩展至生物药。根据药物类型、不同政策,独占权主要分为以下几类。
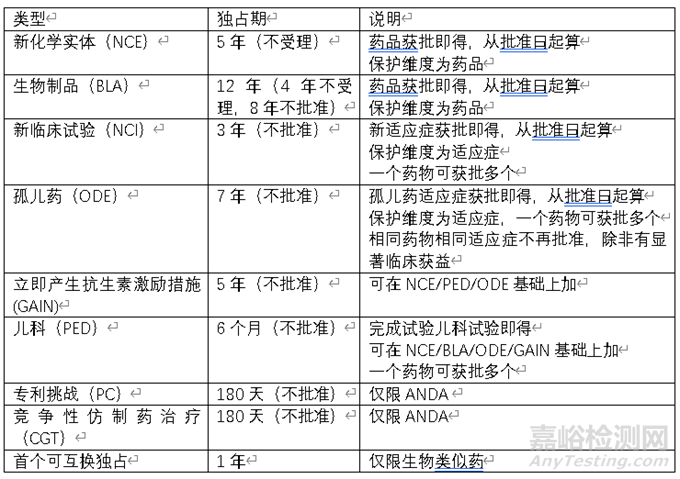
目前FDA提供相关数据库查询药物独占权信息。以下为泽布替尼和西达基奥仑赛的独占权情况。
通过FDA橙皮书数据库,可以查询到泽布替尼独占权信息
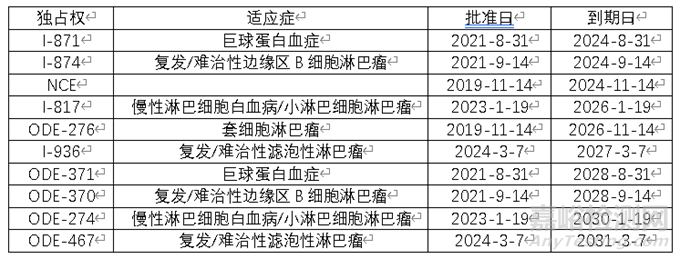
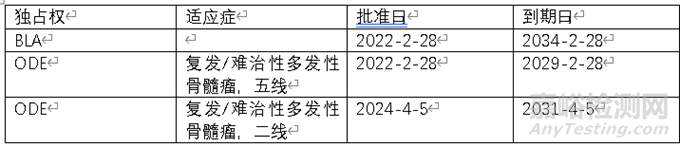
通过FDA紫皮书数据库以及孤儿药数据库,可以查询到西达基奥仑赛独占权信息
三、欧盟试验数据保护制度
欧盟试验数据保护制度起始于1987年,并不按照药物类型区分独占期,分为以下几种
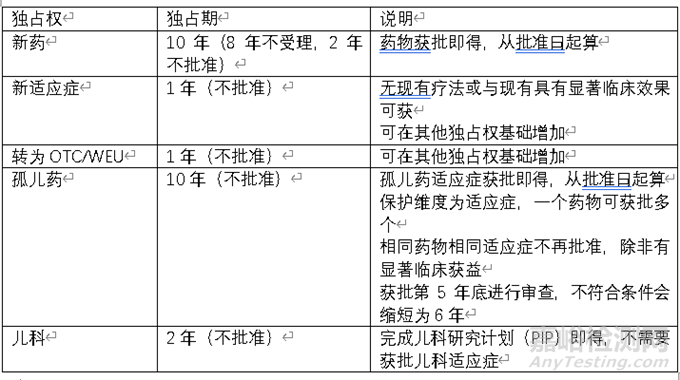
目前欧盟数据库并未提供相关独占权到期日,需要根据适应症获批情况自行计算。
四、 日本试验数据保护制度
日本试验数据保护制度开始于1979年,本质是药物再审查制度,即药物被批准上市后一段时间内,根据其真实诊疗中的临床数据,重新审查有效性和安全性,在此期间不受理仿制药、生物类似药注册申请。
目前独占期仅在PMDA审查文档有记录,以英夫利昔单抗为例。
2007年1月26日,英夫利昔单抗在日本获批用于治疗白塞病引起的难治性葡萄膜炎,再审查期限为10年。

五、加拿大试验数据保护制度
加拿大试验数据保护制度开始于11995年,独占期种类不多,同样未区分化药和生物药。

六、 中国试验数据保护制度
我国试验数据保护制度开始于2002年,彼时的《药品管理法实施条例》规定化药独占期为6年。2018年,国家局《药品试验数据保护实施办法(暂行)(征求意见稿)》系统规定了各类药品保护期,化药6年独占期,生物药12年独占期。2022年,《药品管理法实施条例(修订草案征求意见稿)》表述为自药品上市许可持有人获得药品注册证书之日起6年内,其他申请人未经药品上市持有人同意,申请前款数据申请药品上市许可的,国务院药品监督管理部门不予许可。
七、小结
目前国际上,试验数据保护制度主要分为2类,以欧美国际为代表的创新激励为目的,和以日本为代表的药物安全监控为目的。这些制度运行多年,提供了不少宝贵经验。而我国虽然有不少文件讨论试验数据保护制度,但并未真正落实下来。希望未来国内能够参考国际经验,更好地保护新药创新。
八、参考资料
1.FDA橙皮书数据库
2.FDA紫皮书数据库
3.FDA孤儿药数据库
4.EMA Data exclusivity, market protection, orphan and paediatric rewards
5.Pharmaceutical Regulations in Japan 2020
6.日本药监局
7.加拿大药监局

来源:Internet


