您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2024-06-13 08:50
今年初退休的CDER主任Janet Woodcock博士曾经提问,药监部门做了这么多的工作,如何评价药品的质量状态呢?我们就来通过报告中的一些关键数据,看看FDA是怎么量化其质量监管工作的。
工作量:4819家生产场地,776次药品质量检查,94封警告信
全球有4,819个药品生产场地受到FDA监管,总数比五年前增加了14%。约42%位于美国,印度有585个,比五年前增加了16%,中国有484个,比五年前增加了25%,增幅和韩国、墨西哥排在最前。报告中有详细的国家地区分布和变化。
2023财年,FDA进行了776次药品质量保证检查,比2022财年完成的548次增加了40%,尽管这个数字比新冠疫情前(2019财年)的1258次下降了超过38%,但已经是疫情后时代的新高。

2023财年,FDA因药品质量发出了94封警告信。下图显示了过去五年按国家和地区划分的警告信趋势。值得注意的是,80%的警告信都是发给OTC生产场地的,这些检查数量仅占2023财年检查总量的不到20%,超过一半是关于洗手液、二甘醇(DEG)或乙二醇(EG)污染的。因此,警告信的年度趋势分析的参考价值会受到很大影响,识林的分析中,会单独考虑这部分警告信。

检查合格率:中国和印度企业的数据能反映水平吗?
2023年,FDA生产场地目录中有25%印度场地接受了检查,而中国只有6%。报告中指出,对于印度,检查覆盖率较高是由有因检查驱动的,而对于中国,报告则归咎于旅行限制,导致检查延迟。(注:FDA的2023财年是指2022.10.01到2023.09.30)
值得注意的是,报告中指出,在疫情前(2019财年)检查的覆盖率在32%-39%之间,也就是说,如果FDA恢复疫情前的检查频率(如果不是更高的话),对中国药企的检查应该在2023财年的5-6倍,这种趋势,国内的企业应该已经感觉到了,据识林了解,接下来俩个月(2024年6-7月),FDA已经派出多个检查组,在国内多家企业连续检查。
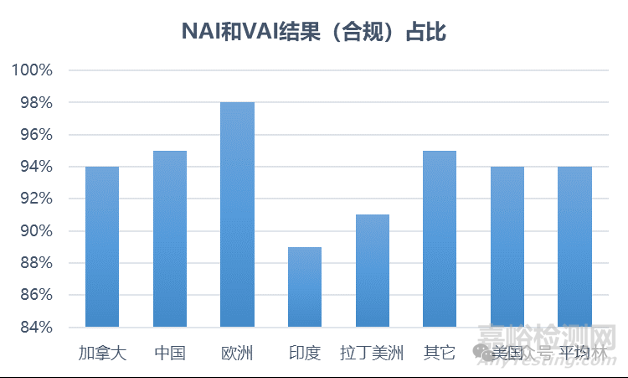
另外,报告中还统计了生产场地目录中不同国家和地区最近一次检查合格的比例,NAI(No Action Indicated)是常说的零缺陷,VAI(Voluntary Action Indicated)是自愿整改,通常可以把NAI和VAI视为通过检查,而OAI(Official Action Indicated)则表示可能采取官方行动,如果没有可接受的缺陷回复和整改,可能收到警告信、进口禁令等。从数字看,中国企业的最近一次检查通过率高达95%,远高于印度的89%,甚至高于美国本土企业和平均水平,仅次于欧洲。
这个数字可能反映出我国企业过去在质量管理和合规能力建设取得的成果,也可能反映出FDA在检查资源配置上有所侧重。FDA经常被美国国会质询场地目录中的“最近一次”发生在三年内、五年内还是十年内,相比印度企业过去两年接受的暴风骤雨般的检查,我国大部分企业的“最近一次”可能还是疫情前。
无论如何,中国企业检查通过率全球第二的结果,是FDA过去执法尺度的客观反映,未来是不是按照这个尺度,恐怕并不乐观。更遗憾的是,我们和印度企业在这个数字上的差异,似乎并没有反映到FDA和美国市场对中国制药质量的认可度上。
另外,前几年的报告会公布场地检查分数(Site Inspection Score),这是FDA基于过去10年药品质量检查结果的历史数据计算的分数,范围是0-10分,得分越高表示CGMP合规性越好。FDA在2024年1月23日更新的“MAPP 5014.1 Rev.1 了解 CDER 基于风险的场地选择模型”中新增一个评分指标--企业所在国家或地区的企业合规历史,这个分数就是重要参考。遗憾的是,2023财年的报告中并未公布这个数据,最后一次看到中国的数据,是在2020财年的报告中:美国(7.62)、欧盟(7.59)和加拿大(7.56)的平均分高于全球平均,而中国(7.23)、印度(6.87)和拉丁美洲(6.69)则低于全球平均水平。这个数据,也许更值得关注。
数字之外的关注点:质量成熟度和药品短缺
2022年11月2日至3日举行的FDA药品科学与临床药理学专家委员会期间,CDER承诺寻求质量管理成熟度利益相关者的意见。2023年,CDER与超过十个利益相关者开展交流,并公开征求意见(2023年9月15日至12月14日),收到了23条自愿性质量管理成熟度计划的反馈。通过2021-2022财年两个QMM试点的经验,CDER制定了一个原型评估方案,并发布在2023年8月的白皮书中。到2024年1月,CDER发布了自愿性质量管理成熟度原型评估方案的评估计划,针对参与的企业,使他们通过原型评估方案获得经验,并供FDA评估。
报告中还强调了药品短缺问题,并提出质量问题仍然是造成药品短缺的关键因素,而需求的增长同样也变得关键(各占40%)


来源:识林


