您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-22 08:51
医疗器械行业,产品的注册检验报告是通往市场准入的通行证,其重要性不言而喻。对于江苏省第二类医疗器械的注册,注册检验报告的质量直接影响着注册进程的顺利与否。本文旨在深入剖析江苏省第二类医疗器械注册检验报告中常见的注册发补问题,为企业提供一份实用的指南,帮助企业在注册路上少走弯路,加速产品上市步伐。
1. 多型号产品检验的盲区:典型性与全面性
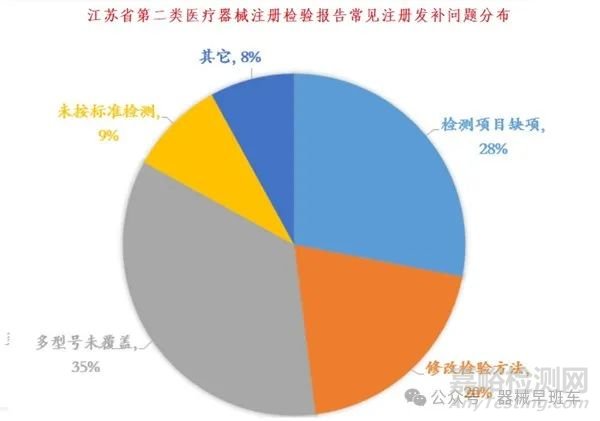
多型号产品的注册检验是发补问题的重灾区。高达35%的补检原因是多型号未被充分覆盖,即企业未能选取具有代表性的型号进行送检,或者忽略了对其他型号的差异性补检。为避免此类问题,企业应深入分析各型号之间的异同,确保送检型号能够代表所有型号的关键特性,同时针对差异性进行专项检测或提供充分的等效性说明。此外,对于新增型号,即使在原注册证涵盖的范围内,也需进行针对性的检验,以证实其符合性。
2. 检验资质与项目完整性:不可忽视的细节
检验报告若未加盖中国计量认证(CMA)章,或检验机构不具备相关检测项目的承检资质,将直接导致报告无效。企业需确保合作的检验机构不仅资质齐全,且所出具的报告包含了所有必要的资质证明文件。同时,28%的补检源于检测项目缺项,强调了严格按照产品技术要求进行全性能检验的重要性。企业应对照技术要求逐项核查,避免遗漏,确保检测的全面性和准确性。
3. 典型性与差异性:精准定位送检型号
检验报告的典型性问题,即送检型号未能体现产品型号间的共性与特性,是另一大常见误区。企业应提交充分的证据,证明送检型号的代表性,包括但不限于设计图纸、性能指标对比分析等。这一环节的严谨性,将直接影响到监管部门对产品安全性和有效性的认可。
4. 完整性与一致性:确保信息准确无误
在完整性方面,除了避免漏检,企业还应防止过度检测。提交多家检测机构报告而无合理解释,不仅可能导致资源浪费,也可能引起监管部门的疑问。一致性方面,检验报告中的所有信息,包括送检单位、产品名称、型号等,必须与注册申报资料保持高度一致。对于使用非终产品作为检测样品的情况,应详细说明理由,并提供相应的依据,确保审查过程的顺畅。
5. 检验报告的细节完善:照片与说明的重要性
检验报告不仅仅是数据的堆砌,还应当包含样品照片和详尽的说明,这不仅能够直观展示产品的外观、包装、内部结构等关键特征,还有助于审评人员快速理解产品设计和构造。清晰、高质量的照片和说明,是提高审评效率、减少误解的有效手段。
结语
江苏省第二类医疗器械注册检验报告的准备是一个细致且专业性强的过程,要求企业从型号选择、检测项目完整性、报告资质、典型性证明、信息一致性到报告细节等多方面精心筹备。通过深入了解上述常见问题及对策,企业可以有效减少注册过程中的发补,加速产品上市步伐。在追求技术创新的同时,确保注册流程的高效与合规,是医疗器械企业可持续发展的关键。

来源:Internet


