您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-24 14:35
ISO 62366在医疗器械的设计过程中扮演着重要的角色,因为它解释了与可用性相关的要求。可用性研究是设计历史文件的重要组成部分。
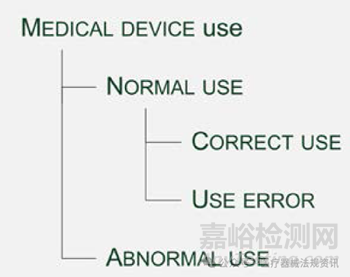
人为因素工程流程的目标是确保在设计阶段评估所有可能的使用、误用和使用错误场景,并实现相关的缓解措施。该可用性工程(人为因素工程)流程允许制造商进行评估并降低与正确使用和使用错误(即正常使用)相关的风险。它可用于识别但不评估或减轻与异常使用相关的风险。
该过程应根据随附文件解决用户与医疗器械的交互问题,包括但不限于:
– 运输;
– 存储;
– 安装;
– 操作;
– 维护和修理;
– 处置。
制造商可以选择实施一个仅关注安全或更广泛地关注安全和其他属性(任务准确性、完整性和效率以及用户满意度等属性)的可用性工程计划。
更广泛的关注也可能有助于满足特定的可用性工程期望,例如需要确认用户能够成功执行与安全无关的任务。制造商还可以实施更广泛的计划,以实现医疗器械的商业效益,该医疗器械不仅使用安全,而且提供卓越的可用性。
用于执行可用性设计过程的努力程度以及方法和工具的选择可能因以下因素而异:
a) 用户界面的大小和复杂性;
b) 与使用医疗器械相关的危害的严重性;
c) 使用规范的范围或复杂性;
d) 存在未知证据的用户界面;和
e) 对已经过可用性工程过程的现有医疗器械用户界面的修改程度。
可用性过程的关键术语
IEC 62366-1:2015/AMD 1:2020中以下几个关键术语如下:
Usability: characteristic of the user interface that facilitates use and thereby establishes effectiveness, efficiency and user satisfaction in the intended use environment.
可用性:用户界面的特征,它有助于使用,从而在预期的使用环境中建立有效性、效率和用户满意度。
Human Factors Engineering: application of knowledge about human behaviour, abilities, limitations, and other characteristics to the design of medical devices (including software), systems and tasks to achieve adequate usability.
人因工程: 将有关人的行为、能力、局限性和其他特征的知识应用于医疗器械(包括软件)、系统和任务的设计,以实现充分的可用性。
Use Error: user action or lack of user action while using the medical device that leads to a different result than that intended by the manufacturer or expected by the user.
使用错误: 在使用医疗器械时,用户操作或不操作导致与制造商预期或用户预期不同的结果。
Abnormal Use: conscious, intentional act or intentional omission of an act that is counter to or violates NORMAL USE and is also beyond any further reasonable means of USER INTERFACE-related RISK CONTROL by the MANUFACTURER
EXAMPLES Reckless use or sabotage or intentional disregard of information for SAFETY are such acts.
有意识的、故意的行为或故意不作为,违反或违背了正常使用,也超出了制造商对用户界面相关风险控制的任何进一步合理手段
(示例:鲁莽使用或破坏或故意无视安全信息。)
Formative evaluation: user interface evaluation conducted with the intent to explore user interface design.
形成性评估: 旨在探索用户界面设计的用户界面评估。
Summative evaluation: user interface evaluation conducted at the end of the user interface development with the intent to obtain objective evidence that the user interface can be used safely, strengths, weaknesses, and unanticipated use errors.
总结性评估: 在用户界面开发结束时进行的用户界面评估,目的是获得用户界面可以安全使用的客观证据、优点、缺点和意外的使用错误。
可用性工程流程
IEC 62366-1:2015/AMD 1:2020中定义了人因工程的评估过程,并可总结为以下过程。

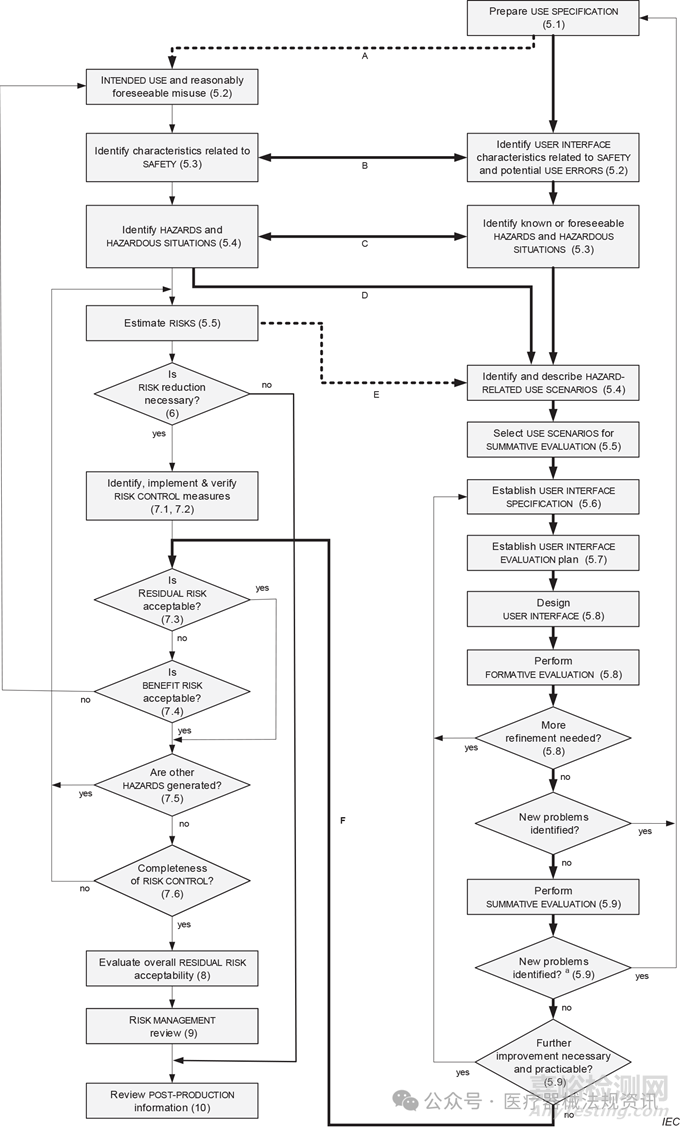
(来源:IEC 62366-1:2020 中的Figure A.5 – The relationship between the RISK MANAGEMENT PROCESS (ISO 14971:2019) and the USABILITY ENGINEERING PROCESS (IEC 62366-1)
1. 定义使用规范
作为第一步,定义使用规范是医疗器械设计过程中评估人为因素的第一步。这些使用规范应包含诸如预期医疗应用、患者群体、与器械互动的团体、用户概况和使用环境等信息。
2.定义与安全和潜在使用错误相关的用户界面特征
其次,在人因工程流程的这一阶段,需要识别与潜在安全相关风险相关的用户界面。基于已识别的与安全相关的用户特征和之前定义的用户规范,现在可以识别可能的使用错误,并评估其相关风险。
3. 识别已知或可预见的危险和危险情况
人因工程流程的下一阶段是识别危险和危险情况。这应在风险分析或风险管理过程的框架内进行。
还应始终在风险管理流程的框架内识别与用户相关的危险情况。
4. 识别与描述与危险相关的场景
识别哪些使用场景与3中识别到的危险相关并会导致患者或使用者以及其他人员受到伤害
5. 选择与危险相关的情景进行总结性评估
在此阶段,应选择之前步骤中确定的与用户相关的危险情况纳入总结性评估。根据ISO 62366,可以选择两种情况:
▪ 所有已识别的用户相关危险情况;
▪ 基于相关风险的用户相关危险情况的子集。
6. 建立用户界面规范
此外,考虑到使用规范、可预见的使用错误和用户相关的危险情况,应定义用户界面规范。
该阶段的输出应包括:
▪ 使用界面的技术要求
▪ 指示是否应使用随附文件
▪ 医疗器械相关培训必要性的说明。
7. 用户界面评估计划
用户界面评估计划人因工程过程的关键阶段。应编制用户界面评估计划。应进行两种不同的评估:形成性评估和终结性评估。
形成性评价计划应包括以下内容:
▪ 形成性评估方法
▪ 正在评估用户界面的哪个部分
▪ 何时执行可用性工程过程中每个用户界面评估。
总结性评估计划包括以下内容:
▪ 使用的方法和正在评估的用户界面部分
▪ 确定使用信息是否清晰并支持正确使用器械的标准
▪ 评估期间随附文件的可用性和培训的提供
▪ 如果有可用性测试,应定义测试环境和收集数据的方法。
8. 进行形成性和总结性评估
最后,在评估计划形成文件后,应实施用户界面,作为第一步,进行形成性评估。
随后应根据相关计划进行总结性评估。重要的是要确保在这些评估中发现的任何进一步的风险。

来源:医疗器械法规资讯


