您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-09-27 08:21
彗星电泳实验,又称为单细胞凝胶电泳试验(Single Cell Gel Electrophoresis,SCGE),是一种用于检测DNA损伤的实验技术,可在单个细胞水平上进行。这种方法能够有效评估DNA损伤的程度,包括由受试物直接引起的DNA链断裂、碱性不稳定性位点导致的DNA链断裂,以及DNA切割修复过程中引起的瞬时DNA链断裂,是一种常用的DNA损伤评估方法。
实验原理:
彗星电泳实验基于凝胶电泳技术,通过在电场中将DNA或其他生物分子移动到凝胶中,利用分子大小和电荷差异产生的不同迁移速度分离这些分子。样品加载到凝胶中后,在电场作用下,带负电荷的分子会向阳极移动,而带正电荷的分子则向阴极移动,形成不同长度的带状图案。这些带状图案中,尾部呈现延伸状,类似彗星,故得名彗星电泳。通过观察这些带状图案,可以评估DNA损伤与修复、细胞凋亡等生物学过程,是一项重要的生物分析技术。
实验步骤:
1、准备细胞:将细胞铺于六孔板中,待其生长到80%-90%的密度,收集细胞并进行计数,然后使用PBS缓冲液将其稀释至每毫升含有100个细胞。
2、玻片(载玻片)制备:使用PBS缓冲液分别制备20毫升含有0.5%正常熔点琼脂糖(NMPA)和0.5%低熔点琼脂糖(LMPA)的溶液。
3、第一层胶制备:将载玻片浸入煮沸的正常熔点琼脂糖溶液中,可使用小烧杯。将其取出后,擦拭去背面的琼脂糖,然后放入60摄氏度烤箱中过夜,随后在室温下保存。
4、第二层胶制备:将准备好的0.5%低熔点琼脂糖溶液放入37摄氏度的水浴锅中备用。取100微升该溶液,并加入10微升细胞悬液(约含有1000个细胞)。充分混合后,滴在第一层胶上,并盖上新的载玻片,用力压平。将其放置在4摄氏度下1-3分钟以固化。需注意,固化时间过长会导致胶变干,使得盖玻片与胶结合紧密,难以取下盖玻片,同时易造成胶一同被扯下。
5、裂解细胞:将玻片缓慢浸入新鲜配制的冰冷细胞裂解液中,保持在4摄氏度条件下裂解2小时。
6、碱化处理及电泳:将玻片取出,置于水平电泳槽中(正极端),并排放置,确保无空隙。倒入新鲜配制的冰冷电泳缓冲应用液,使其高出胶面2毫米,避免气泡存在。放置10至30分钟,通常选用15分钟,以使DNA解链。设定电压为25V,电流为300mA,进行20分钟的电泳。
7、中和:切断电源,取出玻片并置于染缸中,用中和缓冲液(Tris-HCl)浸洗,每次5分钟,共重复3次。
8、染色:在中和后,将玻片晾干至中性状态。然后使用20ul至50μl的PI应用液进行染色,并盖上新的盖玻片。除了中和和染色步骤外,其余各步应在暗处进行,以避免额外的DNA损伤。
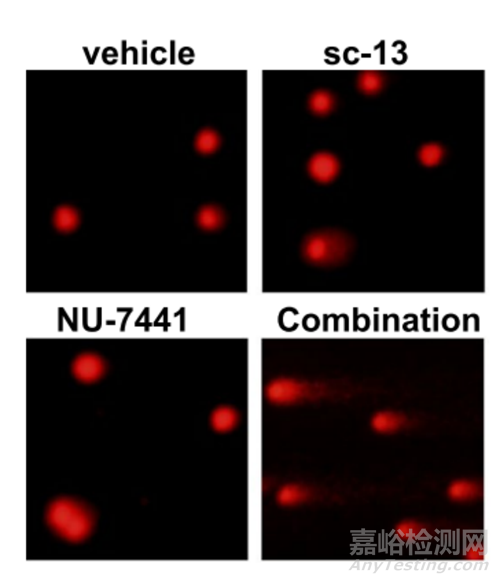
9、镜检:染色后的DNA样品应尽快在荧光显微镜下进行观察。未受损的细胞表现为圆形荧光核心,即彗星头部,没有尾巴。而受损的细胞则呈现出彗尾朝向阳极的形态,形成明亮的头部和尾部。
注意事项:
(1)第7步如果不立即观察,可以在中和后不染色,将玻片放入无水乙醇的染缸中浸泡15分钟,然后捞出晾干并避光保存,需要时再染色。这样处理后的玻片可保存三个月。但如果需要进行脱水处理,则应选择透明底的玻片,因为磨砂玻片表面不平整,在酒精脱水后凝胶会形成颗粒,影响读片质量。
(2)在制备凝胶时,必须防止脱胶现象的发生,为脱胶会导致凝胶结构的破坏,进而影响其完整性和稳定性,从而影响实验结果的准确性和可重复性。
(3)如果 DNA 损伤严重,则产生的碎片就越多、越小,向阳极迁移的DNA碎片量就越多,迁移距离也越长,荧光染色后就能看见“彗星”样尾长并且荧光强度增强。未受损伤的 DNA 大分子则由于细胞膜的阻隔,滞留在原处。
如图所示为M059K细胞彗星结果:

来源:实验老司机


