您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-28 09:39
引言
根据 ISO 14971,作为认证程序的一部分,医疗器械制造商必须对其产品进行获益风险分析。因此,本文将介绍什么是 BRA、如何评估医疗器械的获益和风险以及应使用哪些指导文件。
什么是获益风险分析?
获益风险分析是 ISO 14971 -A Risk Management Standard for Medical Devices的一项要求。它有助于制造商确定医疗器械的获益是否大于风险。在进行获益风险分析之前,首先需要回答以下问题:
· 有哪些潜在好处?
· 有哪些潜在风险?
获益和风险通常不属于同一个评价维度。这就好比,比较苹果和柑橘。客观地比较获益与风险往往并不容易。制造商必须综合已有信息,回答以下问题:
· 用户/患者是否愿意接受医疗器械的潜在风险,以换取其可能带来的获益?
在回答上述问题时,需要注意的是,每个人的风险和获益并不相同。这意味着,同一种医疗器械可能会给不同的患者带来不同程度的风险,并带来不同程度的获益。
评估医疗器械的获益时应考虑哪些因素?
医疗器械的获益是在医疗器械可靠运行并符合预期的条件下推定的。要确定器械的获益,制造商通常需要进行临床评价。不过,有时也可以使用非临床评价来确定医疗器械的获益:例如,可用性测试、计算机建模和模拟、动物试验、细胞试验等。
要评估医疗器械的获益,医疗器械制造商必须考虑几个因素,即:
· 获益类型:如改善生活质量、缓解症状、帮助改善患者功能等。
· 获益的大小:通常是根据特定的标准来衡量的。
· 获益概率:患者获得预期获益的可能性(因为并非所有患者都能获益)。
· 获益的持续时间:预期获益会持续多久?
评估医疗器械风险时应考虑哪些因素?
为了估算医疗器械的残余风险,制造商必须进行风险管理。对于风险的估算可以是定量的,也可以是定性的。此外,临床和非临床方法都可以确认估算的风险和已实施风险控制的有效性。
制造商在主观和定性估计风险时应考虑以下因素:
· 危害的严重程度、类型、可能性和持续时间:这些伤害是使用医疗器械造成的。它们可能是短期的(如皮肤划伤),也可能是长期的(如器官损伤)。
· 与程序相关的伤害:这些伤害是附带的,不是使用产品的结果。例如,植入医疗器械需要进行手术。
在判断器械的风险与获益时应考虑哪些因素?
除上述所有因素外,制造商在判断医疗器械的风险与获益时还必须考虑一些其他因素。即:
· 临床数据的质量:设计和执行不当的临床评价可能会使临床结果不可靠,并削弱 "获益高于风险 "的说法。
· 疾病特征:疾病是退化性的还是稳定型的?如果不治疗,疾病是否会随着时间的推移而恶化?
· 病人的风险承受能力:病人的风险承受能力在很大程度上取决于疾病的严重程度。例如,患有将导致死亡的严重疾病的病人可以承受更高的风险。
· 替代疗法的可用性:是否有治疗疾病的替代疗法?
关于最后一点,一般来说,如果一种器械对一种没有替代疗法的疾病患者有益处,尽管好处很小,这种器械仍有可能获得批准。如果一种风险较高的器械对一部分患者或在特定条件下(如热带环境)具有更高的疗效,也可能获得批准。
制造商应先进行文献调研,可以针对自己的器械或其他制造商的器械撰写最新状态报告(SOTA),然后使用下图直观地展示获益风险比的可接受性,该图有四个象限,解释如下:
· 左上象限:如果所分析的器械在风险相同或较低的情况下能带来更多的获益,则获益与风险比得到改善,获益大于风险。
· 右下象限:如果所分析的器械在风险相同或更高的情况下带来的获益更少,则获益并不比风险大。
· 右上象限和左下象限:需要进行更深入的分析,以确定获益是否大于风险。
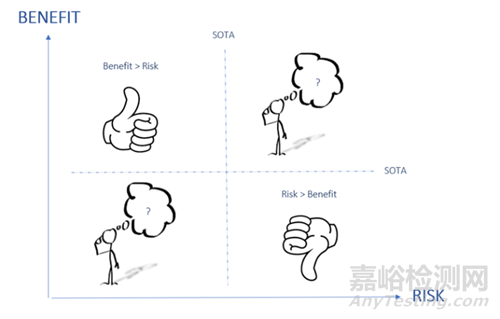
最后,应针对总体目标人群进行获益风险分析。这是因为对于部分目标人群来说,获益风险比可能是可以接受的。
CE 和 FDA 有关获益-风险分析的指导文件
计划在美国销售产品的医疗器械制造商必须获得 FDA认证。为此,需要使用以下指导文件进行获益风险分析:
· 在医疗器械510(k)和De Novo分类中进行获益-风险判定时应考虑的因素(Factors to Consider When Making Benefit-Risk Determinations in Medical Device Premarket Approval and De Novo Classifications)
文件下载链接:
https://www.fda.gov/media/99769/download
· 在510(k)申报中确定不同技术特征的实质等同性时应考虑的获益-风险因素(Benefit-Risk Factors to Consider When Determining Substantial Equivalence in Premarket Notifications (510(k)) with Different Technological Characteristics)
文件下载链接:
https://www.fda.gov/media/89019/download
· 在对医疗器械 IDE 进行获益-风险判定时应考虑的因素(Factors to Consider When Making Benefit-Risk Determinations for Medical Device Investigational Device Exemptions)
文件下载链接:
https://www.fda.gov/media/92427/download
· 医疗器械产品可用性、合规性和执法决策中有关获益-风险的考虑因素(Factors to Consider Regarding BenefitRisk in Medical Device Product Availability, Compliance, and Enforcement Decisions)
文件下载链接:
https://www.fda.gov/media/98657/download
· 在 医疗器械510(k)、De Novo 分类和人道主义器械豁免中进行获益-风险判定的不确定性
文件下载链接:
https://www.fda.gov/media/115672/download
· 提供定期获益风险评估报告 (Providing Postmarketing Periodic Safety Reports in the ICH E2C(R2) Format (Periodic Benefit-Risk Evaluation Report))
文件下载链接:
https://www.fda.gov/media/85520/download
· E2C(R2) 定期获益风险评估报告(E2C(R2) Periodic Benefit-Risk Evaluation Report)
文件下载链接:
https://www.fda.gov/media/99228/download
· E2C(R2) 定期获益风险评估报告(E2C(R2) Periodic BenefitRisk Evaluation Report (PBRER))
文件下载链接:
https://www.fda.gov/media/83371/download
相对应的,医疗器械产品要进入欧盟市场时,要通过CE 标识认证程序,制造商必须遵守欧盟 MDR 2017/745 附件 XIV 或欧盟 IVDR 2017/746 附件 XIII 和 XIV。此外,以下指导文件也在进行获益-风险分析中参考:
· 临床评价—等效性比较 制造商和公告机构指南(Clinical Evaluation - Equivalence A guide for manufacturers and notified bodies)- MDCG 2020-5
· 先前根据 MDD 93/42/EEC 或 AIMDD 90/385/EEC 取得 CE 标识的医疗器械需要的临床证据 (Clinical evidence needed for medical devices previously CE marked under Directives 93/42/EEC or 901385/EEC)- MDCG 2020-6
· PMCF 计划模板(Post-market clinical follow-up (PMCF) Plan Template) - MDCG 2020-7
· PMCF 评估报告模板(Post-market clinical follow-up (PMCF) Evaluation Report Template) - MDCG 2020-8
· 安全与临床绩效摘要(Summary of safety and clinical performance) - MDCG 2019-9
· 欧盟 MDR 2017/745 规定的医疗器械临床研究中的安全性报告(Safety reporting in clinical investigations of medical devices under the Regulation (EU) 2017/745) - MDCG 2020-10/1
· 临床研究的安全性报告(Safety reporting in clinical investigations) - MDCG 2020-10/2
· 临床评价评价报告模板(Clinical evaluation assessment report template) - MDCG 2020-13。
临床评价的获益风险分析
在临床评价中,有的医疗器械给患者带来益处的可能性低,但给临床研究的参与者带来安全风险高,通过审批上市的可能性也就较低。
临床评价的获益风险分析必须包括以下内容:
· 临床背景,包括需要治疗、管理或诊断的临床病症、病症的流行程度以及病症的自然病程。
· 目标人群已有的替代医疗器械。应提供以下信息:历史治疗方法、现有医疗方案(保守治疗、手术治疗、药物治疗)和现有医疗器械。
此外,为了提高医疗器械产品的获批可能性,在决定风险的可接受性时,制造商应找出现有疗法的不足之处,以确定其器械是否解决了现有治疗方案中的重大差距。当其器械未能解决重大差距时,表明该器械比现有产品和疗法的获益-风险比更优,也是增加医疗器械产品获批成功率的有效途径。

来源:医疗器械


