您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-09 16:57
一,抗体分子序列确认
在大分子药物开发中,确定候选分子是核心步骤,类似于化学药物的PCC(临床前候选化合物)。以下是大分子药物开发的标准流程,不同公司可能会根据具体情况有所调整:
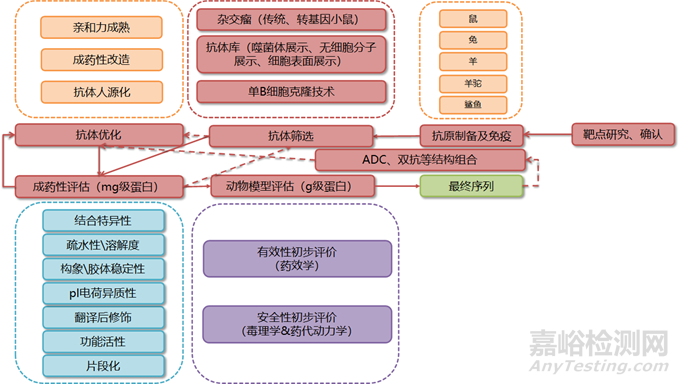
1.靶点确认与药物形式选择:
o收集全面信息,确认目标靶点。
o确定抗体药物的形式,例如单克隆抗体(单抗)、双特异性抗体(双抗)、抗体药物偶联物(ADC)等。
2.抗原制备与免疫:
o制备相应的抗原。
o选择合适的动物进行免疫。
3.抗体筛选:
o利用杂交瘤技术、抗体库筛选或单B细胞克隆技术筛选产生的抗体。
o筛选出阳性克隆。
4.序列分析与优化:
o对阳性克隆进行测序。
o通过瞬时转染(瞬转)表达毫克级别的蛋白。
o进行成药性分析。
o如有需要,对序列进行进一步优化。
5.候选分子筛选:
o通过反复筛选和优化过程,确定若干候选分子。
6.候选分子的大规模表达与评估:
o对候选分子进行更大规模的瞬转表达或使用稳定转染细胞株表达蛋白。
o在体外和动物模型上评估其有效性和安全性。
7.最终分子序列确认:
o综合评估各方面指标,确定最终分子序列。
8.特殊药物形式的设计:
o对于ADC、双抗等特殊形式的药物,需要进一步设计和优化。
o进行成药性评估和动物模型评估,以确定最优组合结构。
二,临床前研究
在大分子药物开发过程中,CMC(化学、生产和控制)工艺开发是关键环节。以下是详细的流程:

1.CMC工艺开发:
o稳转细胞株构建:开发稳定表达目标蛋白的细胞株。
o上下游工艺:开发和优化细胞培养、蛋白纯化等生产步骤。
o制剂工艺:确定药物的制剂形式,如液体或冻干。
o分析方法开发:开发用于药物质量控制的分析方法。
2.细胞库系统建立与工艺放大:
o细胞库系统:建立主细胞库和工作细胞库。
o上下游工艺放大:将实验室规模的工艺放大到中试规模。
o分析方法验证:验证分析方法的准确性和可靠性。
3.中试批次放大生产:
o中试生产:在中试规模下生产药物,以模拟商业生产条件。
o稳定性研究:评估药物在不同条件下的稳定性。
o结构表征研究:详细分析药物分子的结构。
o毒理学研究:评估药物的安全性。
o药效学研究:评估药物的疗效。
o药代动力学研究:研究药物在体内的吸收、分布、代谢和排泄。
o生产过程控制:包括细胞库、生产终末细胞、细胞培养收获液的鉴定,以及除病毒能力验证。
4.临床试验申请(IND):
o资料整理:整理所有研究数据和生产信息。
o撰写申报材料:准备临床试验申请文件。
o提交IND:向监管机构提交临床试验申请。
三,临床试验和CMC开发
在获得临床默示许可后,临床试验和CMC(化学、生产和控制)开发工作将同步进行。以下是详细的流程:
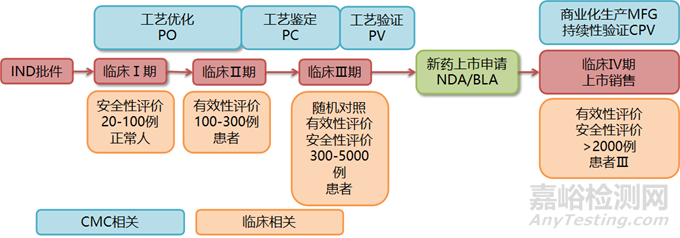
1.临床试验:
oⅠ期临床试验:在正常人体上进行,主要进行安全性评估。对于特殊药品(如抗肿瘤药物),可能直接在患者上进行。
oⅡ期临床试验:在患者上进行,主要进行有效性评估。
oⅢ期临床试验:在更多的患者上进行随机对照试验,进一步对有效性和安全性进行评估。达到预期指标后,可以进行新药上市申请(NDA/BLA)。
oⅣ期临床试验:上市后进行,考察药物在广泛使用条件下的疗效和不良反应,评价在普通或特殊人群中使用的利益与风险关系,以及改进给药剂量等。
2.CMC开发工作:
o工艺优化(PO):对上下游工艺、制剂工艺、分析方法进行进一步的完善。
o工艺鉴定(PC):细化控制策略和质量标准。
o工艺验证(PV):调试生产设备,提高工艺与设备的适配性,确保商业化生产的产品质量稳定可靠。
3.锁定工艺和质量标准:
o完成所有必要的CMC开发工作后,锁定各项工艺、方法、质量标准。
4.新药上市申请(NDA/BLA):
o达到Ⅲ期临床试验指标后,提交新药上市申请。
5.商业化生产(MFG):
o获批后,开展商业化生产,供应给患者用药。
6.上市后持续验证(CPV):
o上市后,对生产各环节进行持续性验证,持续保障药品安全、有效、质量可控。
整个流程确保了药物从临床试验到商业化生产的顺利过渡,并保障了药品的质量和安全性。

来源:Uselong Biotech


