您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-11-05 11:35
刚刚,国家药品监督管理局医疗器械技术审评中心发布《内窥镜手术用剪注册审查指导原则(征求意见稿)》,内容如下:
内窥镜手术用剪注册审查指导原则
(征求意见稿)
本指导原则旨在为注册申请人进行无源手术器械中内窥镜手术用剪的注册申报提供参考,同时也为技术审评部门审查注册申报资料提供参考。
本指导原则是对无源内窥镜手术用剪注册申报资料的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围
本指导原则适用于《医疗器械分类目录》(原国家食品药品监督管理总局公告2017年第104号)中管理类别为Ⅱ类、在内窥镜检查和手术中配合内窥镜使用的无源内窥镜用剪,分类编码为02-03-03。
本指导原则适用范围不包含与手术机器人配套使用的手术用剪及有源内窥镜手术用剪。
其他无源内窥镜手术用剪类产品,如宫腔镜手术用剪,可参考本指导原则中适用部分。
二、注册审查要点
(一)监管信息
1.申请表
注册申请人应按照填表要求填写申请表,明确产品名称、分类编码、型号规格、产品组成、适用范围等信息。
(1)产品名称
产品名称应符合《医疗器械通用名称命名规则》的要求,产品名称由一个核心词和不超过三个的特征词组成。建议参照《无源手术器械通用名称命名指导原则》确定产品名称,核心词为“剪”,特征词可按使用和提供形式、结构特征、使用部位或作用对象等方式来命名,如鼻窦镜手术剪、膀胱镜手术剪、一次性腹腔镜手术剪等。
(2)管理类别及分类编码
依据《医疗器械分类目录》,无源内窥镜手术用剪管理类别为II类,分类编码为02-03-03。
(3)注册单元的划分
注册单元划分应符合《医疗器械注册单元划分指导原则》的要求,原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
产品结构组成、性能指标或加工处理方式不同而导致产品适用范围不同时,原则上划分为不同的注册单元。例如鼻窦镜手术剪与腹腔镜手术剪应划分为不同的注册单元。
一次性使用内窥镜用剪与可重复性使用内窥镜用剪建议划分为不同注册单元。
2.产品列表
以表格形式列出拟申报产品的型号、规格、结构及组成、附件(若有),以及每个型号规格的标识(如型号或部件的编号,器械唯一标识等)和描述说明(如尺寸、材质等)。
(二)综述资料
1.概述
1.1描述申报产品的通用名称及其确定依据。
1.2描述申报产品的管理类别,包括:所属分类子目录名称、一级产品类别、二级产品类别,管理类别,分类编码。该产品管理类别为II类,子目录为02无源手术器械-03手术器械 剪-03内窥镜用剪。
1.3描述申报产品适用范围。
1.4如适用,描述有关申报产品的背景信息概述或特别细节,如:申报产品的历史概述、历次提交的信息,与其他经批准上市产品的关系等。
2.产品描述
2.1工作原理
内窥镜手术用剪刀头为一对带刃口的刀片,通过手柄操作传递、控制刀头刀片的运动,供施行内窥镜手术时剪切使用。
2.2原材料
详述产品所用原材料(包括交联剂等任何生产过程中加入的成分及预装器材等)的中文化学名称、化学结构式/分子式、材料商品名(若有)、材料代号/牌号(若有)、符合的标准以及与人体的接触方式。进口产品的材料应与原产国上市证明文件/说明书批准的范围一致。
若刀头带有涂层的,应给出涂层成分、涂层特征及作用、涂层在器械上的位置及涂覆范围、涂层涂覆方式及工艺。考虑灭菌方式对涂层的影响,如涂层对环氧乙烷解析的影响。若涂层对包装有特殊要求,建议明确。一般来说,涂层成分宜为有长期医疗器械安全应用史的化学物质。
2.3交付状态及灭菌方式
以无菌方式提供的内窥镜手术用剪,应描述灭菌实施者、灭菌方法、灭菌有效期。
以非无菌方式提供的内窥镜手术用剪,应明确推荐的清洗、消毒工艺(方法和参数)和灭菌工艺(方法和参数)。
2.4结构组成及功能
提供产品结构示意图和/或产品图示、使用方法以及区别于其他同类产品的特征等内容。结合实物图或示意图,对产品的结构组成进行详尽描述,可给出横截面图(若不同位置横截面不同,应分别给出)、纵剖面图;应给出头端部分放大结构图,明确不同头端形状。体现手柄操作部分、插入部分、头端部分、转轮部分、冲洗口部分等的细节,不同型号产品若不能被典型性型号覆盖,应分别给出结构组成图示。
该产品通常由头部、杆部或软性导管、转轮(若有)、冲洗口(若有)和手柄组成,头部为一对带刃口的刀片,通过手柄操作传递、控制头部工作。一般头部采用不锈钢材料制成。
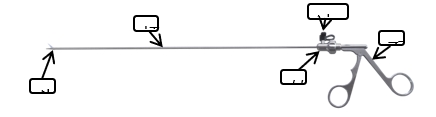
图1 内窥镜手术剪结构组成示例
无源内窥镜用剪典型产品的外形结构图如下:

图2 鼻窦镜手术用剪示意图

图3 腹腔镜手术用剪示意图

图4 膀胱镜手术用剪示意图
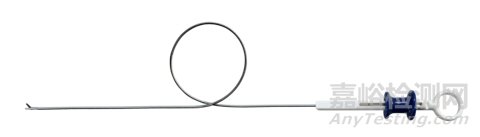
图5 电子膀胱镜手术用剪示意图

图6 刀头示意图
2.5型号规格
对于存在多种型号规格的内窥镜手术用剪,可列表说明各型号规格的区别,对不同型号规格的结构组成、尺寸、性能指标等加以描述,也可采用示意图进行表述。不同型号规格间的所有区别,如工作长度、插入部外径、最大张开幅度等应在对比表中列出。
2.6包装说明
应说明所有产品组成的包装信息,如包装材料、用途等,如有多层包装应分别提供,并提供各层包装的图示。
对于无菌提供的内窥镜手术用剪,产品的包装应与灭菌方式相适应。应提供无菌屏障系统的信息,如材质等,还应说明如何确保最终使用者可清晰的辨识包装的完整性。
若使用者在进行灭菌前需要包装医疗器械或附件时,应当提供正确包装的信息(如材料、成分和尺寸等)。
2.7研发历程
阐述申请注册产品的研发背景和目的。如有参考的同类产品或前代产品,应当提供同类产品或前代产品的信息,并说明选择其作为研发参考的原因。此外,建议在研发背景中描述产品改进的内容、实现方式、解决的技术问题或临床问题等。
2.8与同类和/或前代产品的参考和比较
列表比较说明申报产品与研发参考的同类产品和/或前代产品在工作原理、结构组成、制造材料、性能指标及适用范围等方面的异同。
3.适用范围
内窥镜手术用剪临床应用场景较多,适用范围应尽量体现产品的具体临床应用。建议给出产品配合使用的内窥镜类型、适用的人群、作用的人体部位、禁忌证等信息。
产品的适用范围、适用人群、禁忌证需与申报产品的性能、功能相符。适用范围的描述需清晰准确,如描述为:“产品与腹腔镜配合使用,用于剪切腔内组织。”
明确目标用户及其操作或使用该产品应当具备的技能/知识/培训。
说明产品是一次性使用还是重复使用。
注册申请人需根据申报产品的设计特征,进一步说明其具体的适用人群、预期使用环境等信息。
描述产品的禁忌证,如不适宜使用的人群、疾病等情形。
4.申报产品上市历史
如适用,申请人需提供以下相关资料:
4.1上市情况。申报产品在各国家或地区的上市批准时间、销售情况。
4.2不良事件和召回。
4.3销售、不良事件及召回率。
(三)非临床资料
1.产品风险管理资料
应依据GB/T 42062《医疗器械 风险管理对医疗器械的应用》提供产品风险管理报告。注册申请人应重点说明:申报产品的研制阶段已对有关可能的危害及产生的风险进行了估计和评价,针对性地实施了降低风险的技术和管理方面的措施。产品性能测试对上述措施的有效性进行了充分验证,达到了相关标准的要求。注册申请人对所有剩余风险进行了评价,全部达到可接受的水平。产品风险分析资料应为注册申请人关于产品安全性的承诺提供支持。应对申报产品的可能危害进行判定并列出清单。与安全有关的特性的识别可参考标准YY/T 1437的附录A。
根据GB/T 42062对内窥镜用剪已知或可预见的风险进行判定,列举了有关的可能危险示例的不完全清单(见附件)。注册申请人还应根据自身产品特点确定其他可能危险。针对产品的各项风险,注册申请人应确定是否需要采取控制措施确保风险降到可接受的程度。
2.医疗器械安全和性能基本原则清单
应结合申报产品自身特点说明申报产品符合《医疗器械安全和性能基本原则清单》各项适用要求所采用的方法,以及证明其符合性的文件。对于《医疗器械安全和性能基本原则清单》中不适用的各项要求,应当说明理由。
对于包含在产品注册申报资料中的文件,应当说明其在申报资料中的具体位置;对于未包含在产品注册申报资料中的文件,应当注明该证据文件名称及其在质量管理体系文件中的编号备查。
3.产品技术要求及检验报告
3.1产品技术要求
注册申请人应按照《医疗器械产品技术要求编写指导原则》并结合产品的技术特征和临床使用情况来编制技术要求,对宣称的所有技术参数和功能,应在产品技术要求中予以规定;产品技术要求中的内容引用国家标准、行业标准的应保证其适用性。若以下相关性能指标要求(包括国家标准或行业标准中规定的要求)未适用,注册申请人应在提交注册材料的研究资料中对未适用情况进行合理的说明。
产品技术要求应至少包括以下内容:
(1)外观
内窥镜手术用剪剪刀头的两片应相互吻合,不得有错位现象,刃面不得有卷刃、崩刃现象,其他部位一般应光滑圆润,表面应无非设计预期的锋棱、裂纹、毛刺等。
内窥镜手术用剪头端部分应经过处理,在内窥镜视野中可见的头端部分无定向反射现象。
(2)尺寸
内窥镜手术用剪应明确产品规格尺寸和公差,应标称器械的工作长度、张开角度、杆部外径等,一般采用图表明示。尺寸允许公差参照可参照行业标准中的相关要求(如YY/T 0672.2)。
(3)硬度
内窥镜手术用剪硬度如有国家标准、行业标准要求,应执行相应标准;如无相应标准要求,注册申请人可根据产品实际情况明确硬度要求,但应满足临床使用要求。
(4)表面粗糙度
内窥镜手术用剪的表面粗糙度如有国家标准、行业标准要求,应按国家标准、行业标准执行;如无相应国家标准、行业标准要求,注册申请人可根据产品实际情况明确表面粗糙度要求,但应满足临床使用要求。
(5)剪切性能
剪刀应有良好的剪切性能,切口光滑并能顺利剪切规定的试验材料,剪切后无纤维拉出现象。
(6)开闭灵活性
剪刀开闭应灵活,不应有咬口、卡滞现象。有转轮功能的,刀头应360°内转向自如。
(7)耐腐蚀性能
内窥镜手术用剪的不锈钢部位外表面的耐腐蚀性能可参考相关标准(如:YY/T 0149)的相关试验方法。其他材料用说明书中指定的灭菌方法灭菌后,应无腐蚀现象。
(8)连接牢固度
内窥镜手术用剪各连接部位应牢固可靠,若有焊接,焊缝应平整光滑,无脱焊或堆焊现象。拆卸、装配应方便,装配后连接部位牢固,无松脱现象。
(9)冲洗接头(如适用)
如冲洗接头采用鲁尔接头,可参考相关标准(如:GB/T 1962.2-2001《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头 第2部分:锁定接头》)的相关试验方法。
(10)通水性能(如适用)
应具有良好的通水性能。
(11)化学性能(如适用)
根据不同材料的特性,申请人应对产品与人体接触部分的高分子材料的化学性能制定相应要求,如酸碱度、重金属总含量、还原物质等。
(12)无菌(如适用)
无菌内窥镜手术用剪经确认的方法灭菌后应无菌。若产品灭菌后可能产生残留,则残留量应符合相关标准要求。
(13)其他
企业对宣称的所有其他技术参数和功能,均应在产品技术要求中予以规定。
3.2产品检验报告
可提交以下任一形式的检验报告:
(1)申请人出具的自检报告。
(2)委托有资质的医疗器械检验机构出具的检验报告。
提交自检报告的应符合《医疗器械注册自检管理规定》(2021年第126号)相关要求。
申报产品有多个型号的,可选择典型型号产品进行检验,注册申请人应提供检验样品型号/规格的选择依据。所检验型号/规格需为能够代表本注册单元内其他型号/规格的典型产品。选取用于检验的典型产品时需综合考虑产品的结构组成、制造材料、性能指标、生产工艺(包括灭菌方式等)等方面的影响因素。典型产品应能代表申请注册产品的安全性和有效性,一般选取结构最复杂、功能最全、技术指标最全的型号作为典型产品,并提供典型产品检验覆盖说明。
若一个型号规格不能覆盖,应选择其他不同型号规格进行差异性检验,内窥镜手术用剪关键部分的材料、牌号不同应分别送检。需注意,典型型号/规格不一定是临床常用型号/规格。
4.研究资料
4.1产品性能研究
应当提供产品性能研究资料以及产品技术要求的研究和编制说明,包括有效性、安全性指标的确定依据、所采用的标准或方法、采用的原因及理论基础等。
4.2生物学特性研究
内窥镜手术用剪直接与人体组织接触,应按照《医疗器械生物学评价和审查指南》、GB/T 16886.1的要求对其进行生物相容性评价,并提交生物学评价报告。明确内窥镜手术用剪与人体接触组件或部位的材料性质,如材料牌号、化学成分、生产加工中引入的涂层或阳极氧化等。内窥镜手术用剪属于与组织接触的短期外部接入医疗器械,需考虑的生物学评价终点至少包括:细胞毒性、致敏反应、刺激或皮内反应,材料介导的致热性,急性全身毒性。
4.3产品清洁、消毒、灭菌工艺研究
内窥镜手术用剪可根据市场需求,以无菌形式或非无菌形式提供。
注册申请人应对以无菌形式提供的产品明确其灭菌工艺(方法和参数)和无菌保证水平(SAL),并提供灭菌确认报告。如灭菌使用的方法容易出现残留,应当明确残留物信息及采取的处理方法,并提供研究资料。
注册申请人应对非无菌提供的内窥镜手术用剪明确推荐的灭菌工艺(方法和参数)及所推荐的清洁(如适用)、消毒(如适用)、灭菌方法确定的依据;对可耐受两次或多次灭菌的产品,应当提供产品相关推荐的清洁(如适用)、消毒(如适用)、灭菌方法耐受性的研究资料。
4.4产品稳定性研究
(1)货架有效期
应当提供货架有效期和包装研究资料,证明在货架有效期内,在生产企业规定的运输贮存条件下,产品可保持性能功能满足使用要求,具有微生物限度要求的产品还应当符合微生物限度要求,以无菌状态交付的产品还应保持无菌状态。可以提交实时老化结果,也可以提交加速老化结果,加速老化可按YY/T 0681.1《无菌医疗器械包装试验方法 第1部分:加速老化试验指南》要求提交产品及包装的效期验证方案及报告。
(2)使用稳定性
应当提供使用稳定性/可靠性研究资料,证明在生产企业规定的使用期限/使用次数内,在正常使用、维护情况下,产品的性能功能满足使用要求。
非无菌提供的内窥镜手术用剪通常为可重复使用的产品,注册申请人在进行产品使用稳定性验证时应考虑产品材料、使用频率、清洗消毒方法对产品的影响等因素,结合实际临床使用的情况,获得使用期限/使用次数的验证结果。
(3)运输稳定性
在宣称的有效期内以及运输(例如:震动、振动、温度和湿度的波动)储存条件下,提供保持包装完整性的依据。企业需提交产品包装验证和运输验证资料。
包装研究资料应包括封口试验以及包装材料对灭菌的适应性研究。可依据GB/T 19633、GB/T 4857系列标准对包装进行分析研究和评价。直接接触产品的包装材料的选择应至少考虑以下因素:包装材料的物理化学特性;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌过程的适应性;包装材料所能提供的物理、化学和微生物屏障保护;包装材料与使用者使用时的要求无菌开启的适应性;包装材料与标签系统的适应性。
需提交运输稳定性验证资料,可依据YY/T 0681.15、GB/T 4857系列标准等进行验证并提交运输稳定性验证资料,证明在规定的运输条件下,运输过程中环境条件不会对医疗器械的特性和性能造成不利影响。
4.5其他资料
该产品已列入《免于进行临床评价医疗器械目录》(以下简称《免临床目录》),对于符合《免临床目录》中分类编码为02-03-03的产品,注册申请人需提交申报产品相关信息与《免临床目录》所述内容的对比资料以及申报产品与已获准境内注册的《免临床目录》中医疗器械的对比表,具体提交资料的要求可参照《列入免于进行临床评价医疗器械目录产品对比说明技术指导原则》。新型结构设计不产生新风险或风险程度降低的,可免于进行临床评价,但应提交相关支持性资料。
(四)临床评价资料
对于符合《免临床目录》条件的内窥镜手术用剪,注册申请人无需提交临床评价资料。若无法证明申报产品与《免临床目录》产品具有等同性,则应按照《医疗器械临床评价技术指导原则》提交临床评价资料。
(五)产品说明书和标签样稿
产品说明书和标签的编写要求应符合《医疗器械说明书和标签管理规定》(原国家食品药品监督管理总局令第6号)、YY/T 0171 《外科器械 包装、标志和使用说明书》和YY/T 0466.1《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》等相关法规文件和相关标准的要求。所提交的文本和标签样稿应内容清晰、完整。说明书中的适用范围、禁忌证、注意事项、警示信息、有效期等信息应与产品综述资料、研究资料和临床评价资料中所描述及验证的内容一致。产品说明书还应包括以下内容(不限于此):
1.非灭菌提供的产品,应明确使用前的处理及灭菌方式;
2.可重复使用的产品,应明确重复使用次数,以及重复使用后的清洗及灭菌方法;
3.应注明产品贮存环境要求;
4.如预期与其他产品联合配套使用,应明确与其配合使用方法;
5.应按照相应行业标准,明确内窥镜手术用剪的标志、标识。
6.在未完整阅读产品说明书之前请勿尝试操作该产品。
7. 注意事项、警示性及提示性说明的一般内容如下:
(1)产品规格选择说明(如适用);
(2)开启包装的注意事项;
(3)配合使用器械的要求(如适用);
(4)使用中的注意事项,如建议腹腔镜直视下操作等;
(5)使用后的注意事项,如产品用后处置等;
(6)依照使用方法操作;
(7)产品为一次性使用医疗器械,不得重复使用(如适用);
(8)无菌产品内包装如有破损,严禁使用;
(9)超过使用期限的产品严禁使用。
(六)质量管理体系文件
注册申请人应按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》中附件5《医疗器械注册申报资料要求及说明》,提交申报产品的质量管理体系文件。
三、参考文献
[1]国务院.医疗器械监督管理条例:中华人民共和国国务院令第739号[Z].
[2]国家市场监管总局.医疗器械注册与备案管理办法:总局令第47号[Z].
[3]原国家食品药品监督管理总局.医疗器械说明书和标签管理规定:总局令第6号 [Z].
[4]国家药品监督管理局.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告:2021年第121号公告 [Z].
[5]原国家食品药品监督管理总局.医疗器械通用名称命名规则:总局令第19号 [Z].
[6]原国家食品药品监督管理总局.总局关于发布医疗器械分类目录的公告:2017年第104号公告 [Z].
[7]国家药品监督管理局.关于发布医疗器械产品技术要求编写指导原则的通告:2022年第8号[Z].
[8]国家药品监督管理局医疗器械技术审评中心.关于发布医疗器械安全和性能基本原则符合性技术指南的通告:2022年第29号 [Z].
[9]原国家食品药品监督管理总局.总局关于发布医疗器械注册单元划分指导原则的通告:2017年第187号 [Z].
[10]国家药品监督管理局.国家药监局关于发布医疗器械安全和性能基本原则的通告:2020年第18号 [Z].
[11]国家药品监督管理局.国家药监局关于发布免于临床评价医疗器械目录的通告:2021年第71号通告[Z].
[12] GB/T 42062,医疗器械 风险管理对医疗器械的应用[S].
[13] YY/T 1437,医疗器械YY/T 0316应用指南[S].
[14] YY/T 0672.2,内镜器械 第2部分:腹腔镜用剪[S].
[15] YY/T 0149,不锈钢医用器械 耐腐蚀性能试验方法[S].
[16] GB/T 1962.2,注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头 第2部分:锁定接头[S].
[17] GB/T 16886.1,医疗器械生物学评价 第1部分:风险管理过程中的评价与试验[S].
[18] YY/T 0681,无菌医疗器械包装试验方法 系列标准[S].
[19] GB/T 19633,最终灭菌医疗器械的包装系列标准[S].
[20] GB/T 4857,包装 运输包装件系列标准[S].
[21] YY/T 1268,环氧乙烷灭菌的产品追加和过程等效[S].
[22] YY/T 0171,外科器械 包装、标志和使用说明书[S].
[23] YY/T 0466.1,医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求[S].
附件
产品主要危险(源)
|
危害的分类 |
危害的形成因素 |
可能的后果 |
|
|
生物和化学危险 |
生物污染 |
生产环境控制不好。灭菌操作不严格。包装破损。使用时操作不正规。 |
产品带菌,引起患者使用时感染。 |
|
不正确的配方(化学成分) |
材料,未按照设计要求选择适宜材料。小分子物质残留量过大。 |
造成毒性危害。 |
|
|
加工工艺 |
加工工艺控制不严格,后处理工艺控制不严格,加工过程中引入了外来有害物质而未被有效去除。 |
引入有害物质,引起患者感染或造成毒性危害。 |
|
|
再感染和/或交叉感染 |
使用不当、标识不清。 |
引起交叉感染。 |
|
|
环境因素 |
储存或运行偏离预定的环境条件 |
储运条件(如温度、湿度)不符合要求。 |
产品老化。
无菌有效期缩短。 |
|
意外的机械破坏 |
储运、使用过程中发生意外的机械性破坏。 |
产品使用性能无法得到保证。 |
|
|
由于废物和/或医疗器械处置的污染 |
使用后的产品没有按照要求集中销毁。 |
造成环境污染或者接触人员的感染。 |
|
|
可用性 |
不适当的标记 |
标记不清晰、错误、没有按照要求进行标记。 |
错误使用。
储存错误。
产品辨别错误。 |
|
不适当的操作说明,如:偏离使用说明;说明书关于使用说明不全面 |
包装破损无法识别。
操作要点不突出。 |
无法保证使用安全性。
导致操作失误。 |
|
|
由不熟练/未经培训的人员使用 |
操作不熟练、操作失误。 |
导致延误或不正确治疗。 |
|
|
合理可预见的误用 |
型号规格选用错误。 |
导致无法达到满意的效果。 |
|
|
对一次性使用医疗器械很可能再次使用的危险(源)警告不适当 |
造成重复使用。 |
交叉感染。 |
|
|
违反或缩减说明书、程序等 |
操作方法、注意事项、储存方法、警示事项等表述不清。 |
重复使用引起感染。
没有集中销毁造成环境污染等。 |
|
|
功能性 |
对医疗器械寿命终止缺少适当的决定 |
没有标识产品有效期。 |
超出灭菌有效期的产品被使用,造成细菌感染。 |
|
不适当的包装(医疗器械的污染和/或变质) |
没有进行包装确认。 |
不能确保产品无菌,从而导致出现细菌感染。 |
|
|
再次使用和/或不适当的再次使用 |
产品标识没有明确只限一次性使用。 |
出现细菌感染、交叉感染以及粘膜损伤等现象。 |
|
|
性能缺陷 |
剪切不锋利,造成对组织的二次剪切;
产品表面粗糙、有毛刺;
产品连接部位强度不足,有零部件掉落,断裂;
机械系统设计不当,剪切力不畅滑,剪切过程中卡滞。
材料选择不当,重复使用后生锈。
材料硬度热处理不当,造成剪刀刃口崩裂,断裂脱落。 |
操作失败、损伤患者组织、导致治疗延误。 |
|

来源:国家药监局


