您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-11-14 08:33
一、基本概况
1、简要介绍
欧盟由27个成员国组成,面积414万平方公里,范围覆盖欧洲大部分地区,西起大西洋、东临独联体、南到地中海、北跨波罗的海,囊括除英国、独联体、西巴尔干地区外几乎所有欧洲国家。欧盟总部设在比利时首都布鲁塞尔。
2、人口和行政区划
1、人口分布
欧盟27个成员国人口总计约4.5亿,人口数量前五位的国家依次为:德国、法国、意大利、西班牙、波兰。
2、成员国
目前,欧盟27个成员国包括奥地利、比利时、保加利亚、塞浦路斯、捷克、克罗地亚、丹麦、爱沙尼亚、芬兰、法国、德国、希腊、匈牙利、爱尔兰、意大利、拉脱维亚、罗马尼亚、立陶宛、卢森堡、马耳他、荷兰、波兰、葡萄牙、斯洛伐克、斯洛文尼亚、西班牙、瑞典。
3、2024年出口概况
2024年1-6月,中国向欧盟国家出口医疗器械总计约405.80亿人民币,同比增长约10.11%。
数据来源:广州众成大数据科技有限公司
2024年1-6月,欧盟EUDAMED新增收录医疗器械产品总计47956款,其中4624款由中国企业自主申报。
数据来源:普瑞纯证医疗科技(广州)有限公司
二、欧盟医疗器械监管机构和法规要求
欧盟主管当局及公告机构共同负责欧盟医疗器械的监督管理。其中,公告机构负责对医疗器械上市的认证;主管当局负责公告机构资质的认可。产品上市后的监管由主管当局及公告机构共同负责执行。
欧盟医疗器械认证需要遵循医疗器械法规(MDR, REGULATION (EU) 2017/745)要求。
目前已获得有效医疗器械法规(MDR, REGULATION (EU) 2017/745)发证资质的公告机构共50家,可通过以下欧盟官方网址查询公告机构及其资质范围信息。
欧盟医疗器械法规(MDR, REGULATION (EU) 2017/745)于2017年5月发布,并在2021年5月强制执行。同时截至目前为止,欧盟MDCG小组已发布近140份对法规解读的相关MDCG指南和Q&A,为各相关方(制造商、欧代、公告机构、进口商)提供了深入的法规解读和实用的指导,有助于各相关方更好地理解和执行、并满足欧盟医疗器械法规(MDR, REGULATION (EU) 2017/745)的要求。MDCG 指南和Q&A查询网址。
三、医疗器械定义
欧盟医疗器械法规(MDR, REGULATION (EU) 2017/745)明确医疗器械(Medical device )定义如下:
◆ 用于人类仪器、器具、设备、软件、植入物、试剂材料其他物品,其预期使用由制造商确定,不论单独使用或组合使用,以达到下列一个或多个特定的医疗目的:
- 疾病的诊断、预防、监测、预测、预后、治疗或缓解。
- 损伤或残疾的诊断、监测、治疗、缓解或补偿。
- 对解剖学或生理或病理过程或状态的查验、替代或改变。
- 通过对取自人体(包括器官、血液和组织捐献)的样本进行体外检查的方式来提供信息,而且不是通过药理学、免疫学或新陈代谢的方式在人体内或人体上实现其主要预期作用,但可以通过这些方式辅助其功能。
◆ 下列产品也应视为医疗器械:
- 控制或支持妊娠的器械;
- 专门用于第1(4)条所述器械和本点第一段所述器械的清洁、消毒或灭菌的产品。
相对较于原欧盟MDD指令,现MDR(REGULATION (EU) 2017/745)扩大了医疗器械范围,例如明确了进行器械清洁、消毒、灭菌的产品也属于医疗器械范围,增加无预期医疗用途产品,如隐形眼镜、用于减少/去除或破坏脂肪组织的器械、用于换肤、纹身或脱毛或其他皮肤治疗的激光和强脉冲光器械等,具体内容可参考MDR法规附录XVI清单;此外,还包括专门用于替代器械部件或组件和显著改变器械性能或安全特征或预期用途的器械(Article 23(2) MDR)。
四、医疗器械分类
1、依据
依据(REGULATION (EU) 2017/745)附录VIII对医疗器械进行分类,共有22条分类规则:Rule 1 - Rule 4 非侵入性器械,Rule 5 - Rule 8 侵入性器械,Rule 9 - Rule 13有源器械,Rule 14 - Rule 22 特殊规则。
同时,制造商在进行医疗器械分类时可参考MDCG小组发布的如下分类界定指南文件进行:
◆ MDCG 2021-24 Guidance on classification of medical devices - 对MDR Article 2及MDR附录VIII的补充性解释
◆ MDCG 2022-5 Guidance on borderline between medical devices and medicinal products under Regulation (EU) 2017/745 on medical devices
◆ Background note on the use of the Manual on borderline and classification for medical devices under the Directives
◆ Manual on borderline and classification under Regulations (EU) 2017/745 and 2017/746 v2 - 分类界定结果(每3个月更新一次)
◆ MDCG 2019-11 Guidance on Qualification and Classification of software in MDR and IVDR
此外,如对产品分类有议时可联系欧盟主管当局进行商讨;具体无法确定分类的器械申请分类界定的工作流程可参考“Helsinki Procedure for borderline and classification under MDR & IVDR”。
2、分类
根据产品的风险等级,欧盟MDR (REGULATION (EU) 2017/745)仍将医疗器械分为四类,按风险由低到高依次为:I 类, IIa类,IIb 类,III类,I类器械又分为普通I 类及Is(无菌的I类器械),Im(有测量功能的医疗器械)及Irs(可重复使用手术器械)。
相比于原MDD指令,MDR增加了I类可重复使用手术器械(Irs)类别。其中,普通I 类器械可由制造商自我声明,其它分类的器械均必须要公告机构的强制性认证。
五、认证流程
1、注册流程解读/流程图
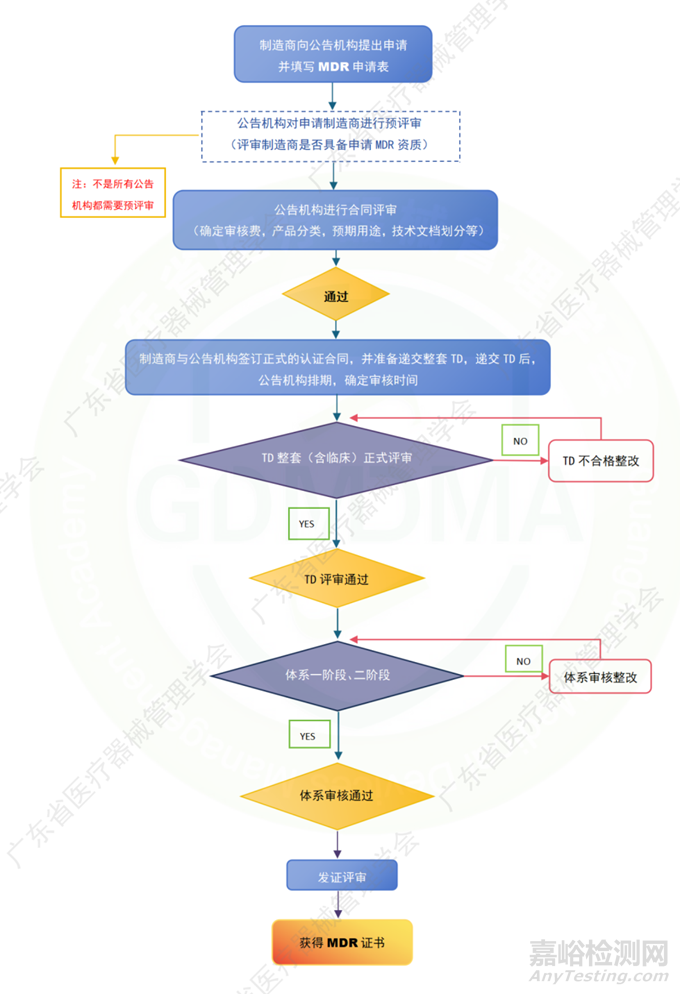
目前欧盟公告机构的认证流程基本一致:包括技术文档审核(含临床审核)、体系现场审核(分一阶段和二阶段审核)、公告机构内部发证评审等几个阶段。
注:
1. TD(Techincal document 技术文档)
2. 各公告机构的报价在技术文档评审次数的涵盖范围上存在差异。部分公告机构的报价涵盖了所有评审次数,而另一些公告机构的报价仅包含一次评审的费用,若后续不合格整改后再次评审,则需另行缴费。
2、认证周期
关于MDR认证周期,欧盟至今没有一个统一的标准流程、标准时间或统一的官方承诺,这是因为MDR认证过程涉及多个方面,包括产品的风险等级(如IIa,IIb,IIb植入,III类)各个公告机构的发证周期及服务承诺不同(这也是市场竞争的要素之一),以及后续制造商可能的整改周期等。
一般来讲,大多数市场上反馈的认证周期约为1年半至两年(成熟技术的IIa/IIb类产品)。然而,就当前实际状况而言,欧盟当下的医疗器械法规(MDR)认证资源相对紧缺,故而建议制造商尽早开启MDR认证流程,以便早日获取证书。
3、认证费用
欧盟目前没有一个统一的医疗器械认证费用标准。由于公告机构之间的市场竞争以及各自不同的服务模式,不同的公告机构认证费用存在差异。此外,公告机构在估算认证费用时,还需综合考虑多个因素,如产品的风险等级(如Ⅱa,Ⅱb), 技术文档的划分,产品的技术特性(如是否包含WIFI功能、是否要求无菌处理)以及制造商的生产规模等。
一般来说,一个普通的Ⅱa 类产品的认证费用(一套技术文档)会在30w-45w之间。具体情况需与公告机构沟通。
前四大公告机构收费情况可在附件点击链接了解详情。
◆ NB2797 BSI (NL)
◆ NB0123 TUV SUD (DE)
◆ NB0197 TUV Rheinland (DE)
◆ NB1639 SGS (BE)
4、符合性评估路径
医疗器械的上市路径会根据其分类的不同而有所差异。MDR(Regulation (EU) 2017/745)规定了不同分类产品所需的上市前审查和认证流程。
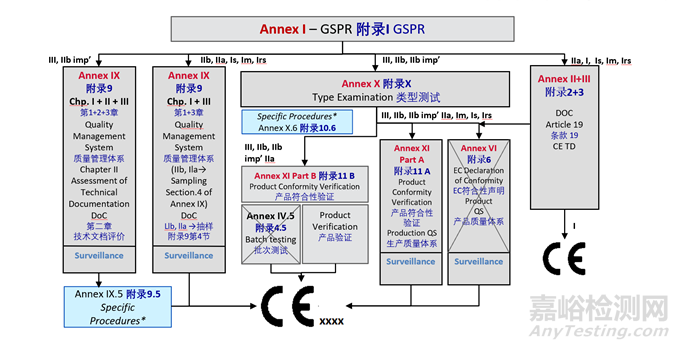
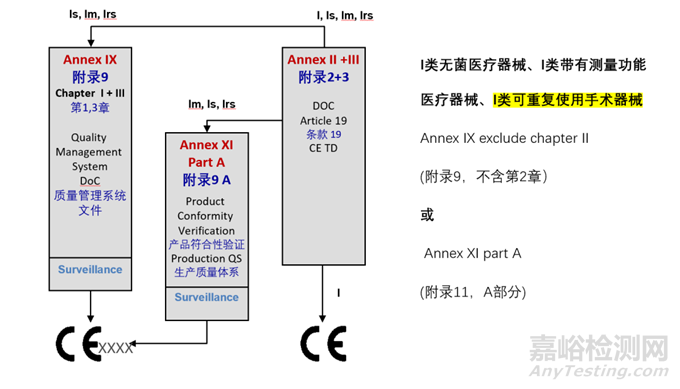
5、认证提交的技术文档
根据MDR 2017/745 Annex II要求,制造商须建立一套精心组织、清晰明了、避免误解、易于检索的产品技术文档(Technical document)。
1、上市前技术文档(MDR附录II要求)
a) 产品描述及规格(包括设备描述,已有设备和市场上类似设备,Basic UDI-DI和 EMDN code,技术文件所覆盖的器械设备分类 Annex VI,器械历史以及类似产品是否在欧盟或其它市场上市)
b) 制造商提供的信息(如产品标签,说明书)
c) 设计及制造资料
d) 基本安全和性能要求GSPR
e) 收益风险分析和风险管理
f) 器械验证和确认(临床前测试数据及临床数据)
g) 符合性声明DoC
2、上市后技术文档(MDR 附录II要求)还需依据上市后的信息积极更新内容:
a) 上市后监管计划(条款84)
b) 定期安全性更新报告PSUR(条款 86)
c) 上市后监督报告(条款85)
d) 风险管理(条款83)
e) 临床评价(条款83)
f) 安全和和临床性能总结(条款32、83,class III和植入器械(非定制/研究器械))
g) 上市后临床跟踪(附录XIV, Part B)
h) 检测并报告趋势(条款88)
3、制造商义务
制造商应保存技术文档、欧盟符合性声明、适用时还有相关证书及修订件和补充件的副本,在欧盟符合性声明中所涵盖的最后器械上市后,该文档应至少向主管机构开放10年。若为植入器械,周期应至少为最后器械已投放市场后的15年。
若主管当局要求,制造商应提供完整的技术文件或其概要。
在欧盟境外注册的制造商应指定欧盟境内唯一的授权代表,并确保其有永久可用的技术文档。
4、技术文档的更新和保存

6、EUDAMED数据库及UDI
1、欧盟EUDAMED数据库
实现MDR目标的一个关键点是建立欧洲医疗器械数据库 (EUDAMED),该数据库希望整合不同的电子系统来集中整理和处理相关的信息。
这些信息包括: 市场上的器械和相关的经营相关方(授权代表、进口商、经销商),符合性评估,公告机构,证书,临床试验,警戒和市场监督。
EUDAMED数据库的目的:
a) 公众和卫生保健专业人员更好地获取信息, 提高总体透明度;
b) 避免多个上报的要求;
c) 加强成员国之间的协调;
d) 简化和促进经营相关方, 公告机构或赞助者和成员国, 成员国之间以及欧盟委员会之间的信息流动。
EUDAMED数据库由六大模块组成,包括经济运营商注册,唯一器械识别(UDI)和设备注册,公告机构及证书,临床调查和性能研究,警戒系统及上市后监督,和市场监督。目前EUDAMED 数据库已开始使用三个模块:参与者注册、唯一器械识别(UDI)和设备注册、公告机构和证书,在此提醒各位制造商,产品在销往欧盟地区之前,应完成在EUDAMED中的产品注册工作。其它模块如临床调查和性能研究、警戒系统和上市后监督、市场监督还没有开始实施。
5、该区域有关UDI的要求
◆ Basic UDI-DI
Basic UDI-DI是欧盟MDR的特殊要求,当医疗器械产品同时具有以下相同特性时,则可以采用相同的Basic UDI-DI:
a) 预期目的
b) 风险等级
c) 基本设计和生产特性
企业根据产品的特性分配相应系列或家族产品的Basic UDI-DI。
Basic UDI-DI 不需要体现在产品标签、包装上,只需要体现在技术文档、符合性声明,并且在最终获得的MDR EU证书上体现Basic UDI-DI。
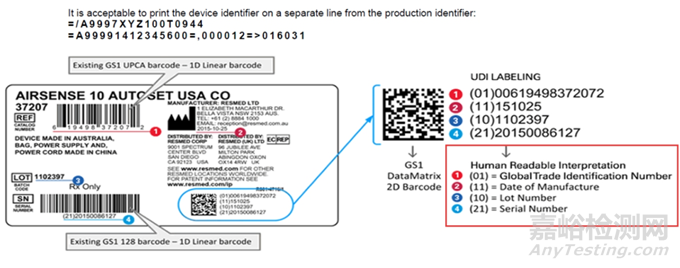
◆ UDI
UDI 系统是医疗器械数据库的一部分,目的是对医疗器械的识别提供一个全球协调化的框架。
UDI 是基于国际认可的器械标识和编码标准创建的一系列数字或字母数字, 以便明确识别市场上的特定器械。
UDI 由 UDI-DI 和 UDI-PI 组成,必须标记在产品标签、包装或产品上。UDI-DI 必须登记在医疗器械数据库中。
7、现场审核要求及注意事项
依据ISO 17021,MDR的现场体系审核分为两个阶段,stage 1 (阶段1)及stage 2 (阶段2)。而MDR (Regulation (EU) 2017/745)质量体系要求是在EN ISO 13485:2016+A11:2021的基础增加了法规的相关要求如警戒系统,欧盟上市后监督、上市后临床跟踪等。
8、临床评价
1、为什么要进行临床评价?
依据MDR章节VI第61条的要求,器械在正常条件下按照预期用途使用时,需要确认其符合MDR附录I中规定的相关“基本安全和性能要求”(GSPRs),同时需评估MDR附录I的第1节和第8节中提到的不良副作用和收益-风险比的可接受性,以上应基于提供充分临床证据的临床数据,包括附录III中提到的适用的相关数据。
制造商应详细说明并证明必要的临床证据的水平以证明符合相关的“基本安全和性能要求”(GSPRs)。临床证据水平的选择应与器械的特点及其预期用途相对应。
同时,制造商应按照MDR章节VI第61条和附录XIV的a部分计划、实施和记录临床评估。
2、基于“基本安全和性能要求”(GSPRs),临床评价需收集充分的临床证据用于:
a) 确认器械的预期用途,临床受益,使用条件及禁忌症。
b) 支持所有宣称的器械预期的适应症,预期的患者(特别是高风险人群),型号,附件,风险管理输出的临床风险点,残余风险的可接受性。
c) 基于预期适用的患者和适应症,确定当前技术水平下管理(包含治疗或缓解或弥补等)该适应症的临床性能及临床安全的最低可接受程度,该可接受程度范围来源于当前技术水平下,其他技术管理(包含治疗或缓解或弥补等)同类型患者和适应症的程度的汇编。
基于行内金标产品(Bench Mark),确定器械的基准范围。
论证器械的临床性能和安全,确认其受益-风险比在当前技术水平下,是可接受的。
◆ 临床证据的定义
指与器械相关的临床数据和临床评价结果,其数量和质量足以对器械是否安全以及在按制造商预期使用时是否达到预期临床益处进行合格评估;
◆ 临床数据
“临床数据”是指器械使用过程中产生的有关安全性或性能的信息,来源如下:
- 器械自身的临床试验
- 等同器械的临床试验或在科学文献中报告的其他研究
- 在同行评审的科学文献中发表的关于器械或等同器械其他临床经验的学术报告
- 来自上市后监测的临床相关信息,特别是上市后临床随访
◆ 实质性等同的定义
在进行临床评估时,二类及以下非植入器械最常采用来源于等同器械的临床数据,需依据MDR附录XIV的a部分第3条的要求从技术,生物学,临床等三个方面进行实质等同性论证。
有关以上实质性等同三个方面具体内容如下:
- 技术:器械的设计相似;在相似的使用条件下使用;具有相似的规格和性能,包括物理化学性能,如能量强度、抗拉强度、粘度、表面特性、波长和软件算法;在相关的地方使用类似的部署方法;具有相似的操作原理和关键性能要求;
- 生物学:器械使用与相同人体组织或体液接触的相同材料或物质,接触的种类和持续时间相似,物质的释放特性相似,包括降解产物和可浸出物;
- 临床:该装置用于相同的临床状况或目的,包括相似的严重程度和疾病阶段,在身体的同一部位,在相似的人群中,包括年龄、解剖学和生理学;具有相同类型的用户;鉴于特定预期目的的预期临床效果,具有类似的相关关键性能。
9、其他注意事项或特别提醒
1、产品带CE标识销售时,请使用最终通过审核的终版说明书和标签。
2、关于抽样的计划:如果企业首次申请多个产品(限于IIa类、非植入或植入WET器械IIb类),公告机构一般为抽样审核,但需要在一个证书周期内,审核完证书覆盖的所有产品 。
MDR 法规提出了对患者及操作者更高的保护。它通过强调受益与危害的分析,明确可用性要求,强调充分的临床证据,明确要求制造商建立、完善并实施上市后监督系统(尤其是主动式监督)等方面来实现。

来源:广东省医疗器械管理学会


