您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-12 15:59
一、基本概况
1、自然环境
澳大利亚位于南太平洋和印度洋之间,由澳大利亚大陆、塔斯马尼亚岛等岛屿和海外领土组成,面积768.82万平方公里。东濒太平洋的珊瑚海和塔斯曼海,北、西、南三面临印度洋及其边缘海。海岸线长36735公里。北部属热带,大部分属温带。年平均气温北部27℃,南部14℃。
2、人口和行政区划
澳大利亚人口约2682万(2023年9月)。51.1%为英国及爱尔兰裔,华裔占5.5%,土著人约占3.2%。官方语言为英语,汉语为除英语外第二大使用语言。约43.9%的居民信仰基督教,其他五大宗教分别为伊斯兰教、印度教、佛教、锡克教和犹太教。无宗教信仰或宗教信仰不明人口占38.9%。
全国划分为6个州和2个地区。6个州分别是新南威尔士州、维多利亚州、昆士兰州、南澳大利亚州、西澳大利亚州、塔斯马尼亚州;两个地区分别是北方领地地区和首都领地地区。各州有州督、州议会、州政府和州长。首都为堪培拉(Canberra)。
3、2024年出口概况
2024年1-6月,中国向澳大利亚出口医疗器械总计约47.77亿人民币,同比下降约3.39%。2024年1-6月,澳大利亚新增注册医疗器械产品总计2033个,其中427个由中国企业获批。
二、医疗器械监管机构和法规要求
澳大利亚治疗用品管理局(Therapeutic Goods Administration,TGA),是澳大利亚的政府机构,负责审核、评估和监控医疗用品,对药品、医疗器械和生物制品进行监管。TGA负责监管治疗产品的供应、进口、出口、制造和广告。TGA通过以下方式监管治疗产品:上市前评估、上市后监测和标准执行、澳大利亚制造商的许可以及验证海外制造商是否符合与澳大利亚同行相同的标准。主要法规:Therapeutic Goods Act 1989《1989澳大利亚医疗用品法案》以下简称“《法案》”、Therapeutic Goods (Medical Devices) Regulations 2002《2002医疗器械法规》以下简称“《法规》。
◆ 什么是治疗用品?
a) 治疗产品被广泛定义为与以下方面相关的用于人类的产品:预防、诊断、治疗或减轻疾病、病症、缺陷或伤害;影响、抑制或改变生理过程;测试人们对疾病的易感性;影响、控制或预防受孕;怀孕检测。这包括以下内容:用作治疗用品制造中的成分或组成部分;用于替换或修改解剖部位。
b) 治疗用品可以包括各种各样的东西,如绷带、妊娠检测试剂盒、草药、组织移植物和扑热息痛。它们通常分为三大类:①药物-包括处方药、非处方药和补充药物,如扑热息痛和紫锥菊。②生物制品-由或含有人类细胞或组织制成的东西,如人类干细胞或皮肤。③医疗器械-包括仪器、植入物和器具,如起搏器和无菌绷带。
c) TGA还监管所谓的其他治疗用品(OTG),其中包括卫生棉条和消毒剂等物品。
三、医疗器械定义
◆ 医疗器械:立法将医疗器械定义为制造商打算单独或组合用于人类以下一个或多个特定目的的任何仪器、装置、工具、机器、器具、植入物、软件、材料或其他类似或相关设备(包括任何体外使用的诊断产品):
a) 疾病的诊断、预防、监测、治疗或缓解
b) 对伤害或残疾进行诊断、监测、治疗、缓解或补偿
c) 解剖结构或生理过程的研究、替换、修改或支持
d) 支持或维持生命
e) 控制受孕
f) 医疗器械消毒
g) 通过体外检查人体标本为医疗目的提供信息
h) 并且不能通过药理学、免疫学或代谢手段在人体内或人体上实现其主要预期作用,但可以通过这些手段辅助其功能
◆ 体外诊断:如果医疗器械是试剂、校准品、对照材料、试剂盒、样本容器、软件、仪器、装置、设备或系统,无论是单独使用还是与其他体外诊断产品结合使用,则该医疗器械是体外诊断医疗器械(IVD)。制造商必须打算将其用于体外检查人体标本,仅或主要用于提供有关生理或病理状态、先天异常的信息,或确定与潜在受体的安全性和兼容性,或监测治疗措施。
体外诊断用于:
a) 提供有关生理或病理状态的信息
b) 监测治疗措施(例如,患者体内的药物或生物标志物水平)
c) 用于筛查疾病、状况和病痛
d) 协助卫生专业人员:进行临床诊断;临床管理决策;确定治疗产品与潜在接受者的安全性和兼容性
四、产品分类
◆ 分类依据
Therapeutic Goods (Medical Devices) Regulations 2002_Schedule 2
◆ MD医疗器械
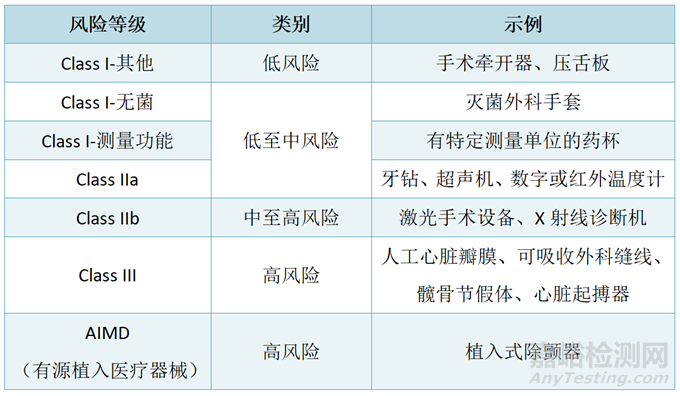
◆ 体外诊断试剂(IVD)
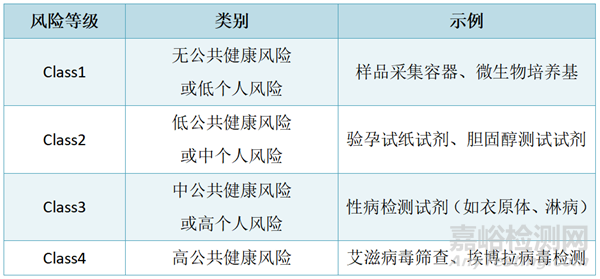
五、市场准入的注册流程
包括体外诊断医疗器械在内的医疗器械根据基本原则进行评估,并符合其预期目的和基于风险的分类。医疗器械的监管框架涵盖了器械的整个生命周期,包括:
a) 上市前评估:符合性评估
b) 上市认证:ARTG纳入
c) 上市后监督:持续遵守所有监管、安全和性能要求和标准
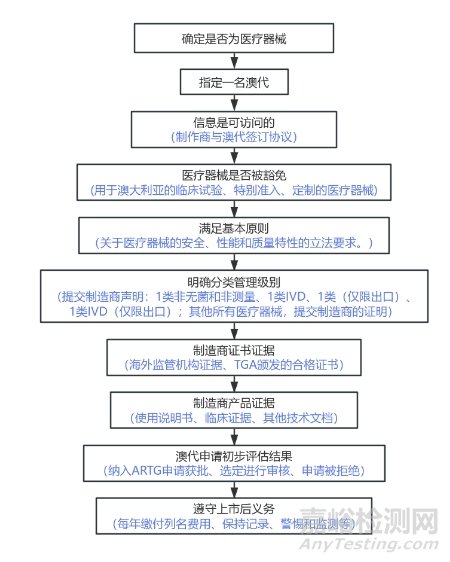
如果你是制造商、sponsor或代理商,你需要一个客户识别号(Client ID),并申请访问在线TGA商业服务(TBS)。此访问权限将允许你管理一些治疗用品注册申请,需要Clint ID来登录TBS,如果你想:
a) 供应澳大利亚
b) 制造
c) 进口到澳大利亚
d) 澳大利亚出口
e) 提交临床试验通知(CTNs)
f) 通知不良事件或召回
g) 被指定为澳大利亚合格评定机构(澳大利亚CAB)
新Sponsor申请电子商务账户(只需要一次)通过 eBusiness Services系统以电子方式提交的澳大利亚治疗用品注册申请。Nea用户需定要通eBusinessServices 以电子方式提交申请。需要e-business 帐户才能访问eBusiness Services。
制造商需要获得TGA上市前批准,向TGA提交医疗器械认证申请,在TGA的医疗用品注册管理系统Australian Register of Therapeutic Goods (ARTG)上进行注册,医疗器械产品在纳入ARTG (ARTG inclusion)后,才能在澳大利亚合法销售。
澳大利亚境外的医疗器械制造商必须指定当地授权代表,称为澳洲代理人或TGA代理人(Australian Sponsor/TGA Sponsor),Sponsor为产品在澳大利亚市场的本地授权代表,并负责向TGA注册医疗器械产品。
在澳大利亚没有公司的海外制造商必须选择本地代表(Australian sponsor or TGA sponsor)负责医疗器械在澳大利亚的ARTG列式。本地代表作为制造商跟TGA的关键联络人,有权限进入TGA系统,代表制造商取得ARTG列式(本地代表为持证人),同时也是TGA开具所有相关费用发票的实体。海外制造商在澳大利亚可以有多个本地代表。如果某人想要供应的医疗器械跟已经纳入ARTG注册的医疗器械完全相同,即使这两种医疗器械的制造商相同,仍然必须得跟TGA申请纳入ARTG注册。这是因为ARTG不仅记录供应到澳大利亚的医疗器械,也记录所有在法律上对投放到市场的医疗器械负责的本地代表。澳大利亚本地代表应与制造商签订协议。
1、MD医疗器械市场准入
◆ 澳大利亚医疗器械注册流程图
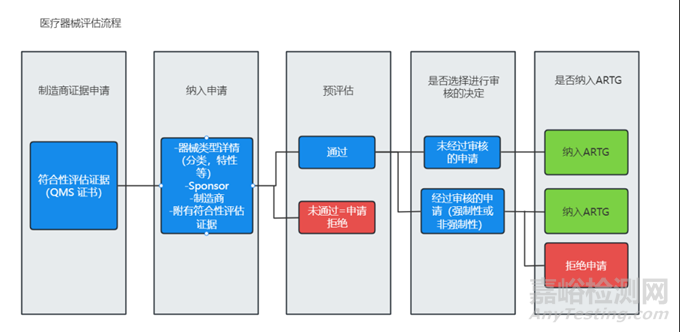
◆ MD医疗器械注册所需的申请文件和资料

制造商需根据医疗器械的风险等级选择符合性评估程序,并签署符合性声明。
澳大利亚共有八种符合性评估程序:全面质量保证程序、EC型式检验、EC验证、生产质量保证、产品质量保证、符合性声明(无需秘书处审核)、有特殊目的的医疗器械的符合性评估程序、临床评估程序。不同的认证途径适用于不同风险等级的医疗器械。全面质量保证程序适用于所有分类的医疗器械。下表总结了每种风险等级的医疗器械最常使用地符合性评估程序,更多关于符合性评估程序的内容请见ARGMD Section 6。
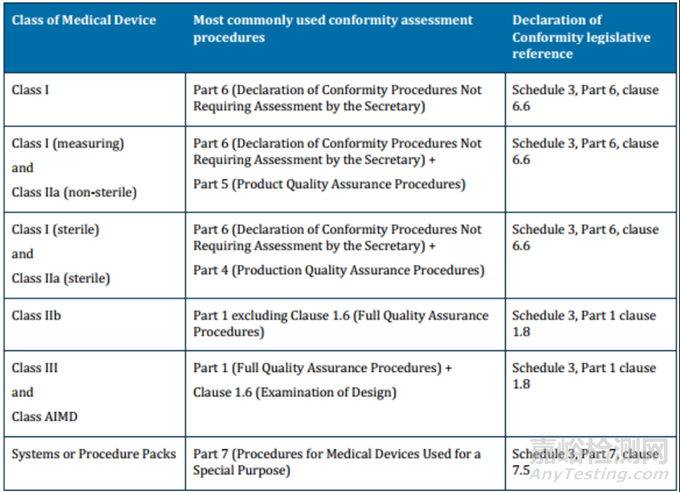
选择不同的认证途径,要签署的澳大利亚符合性声明也不同。官方网站有提供不同认证途径下的澳大利亚符合性声明模板。法规要求符合性声明要由制造商授权的人签署。
符合性评估证据是由TGA或欧盟公告机构签发的证书,用以证明制造商已经被评估并具有适当的系统来生产医疗器械。TGA接受的符合性评估证据的类型有:由TGA签发的TGA符合性评估证书;由Australia–EC MRA签发的符合性证书;由Australia–EFTA MRA签发的符合性证书;由欧盟公告机构签发的CE证书。
◆ MD医疗器械TGA官方费用
纳入ARTG申请费用:Sponsor提交注册申请,并支付申请费用。支付的费用与器械分类有关。
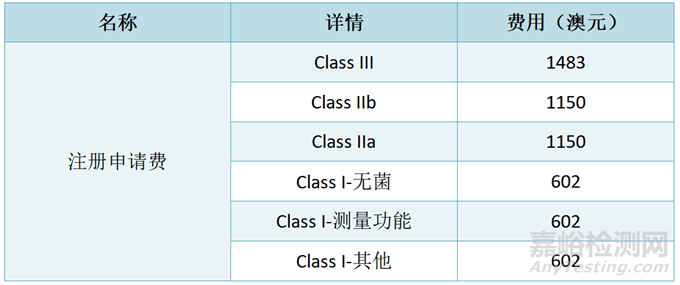
选中审核收取的费用:Class III医疗器械肯定会被选中审核,除非该器械有相关的海外监管/评估机构的有效产品证书。另外,其他等级的器械也有可能会被选中审核。被选中审核有两个审核等级Level 1和Level 2,不同等级审核力度不一样,收取的评估费用也不一致。以下是被选中审核收取的费用。

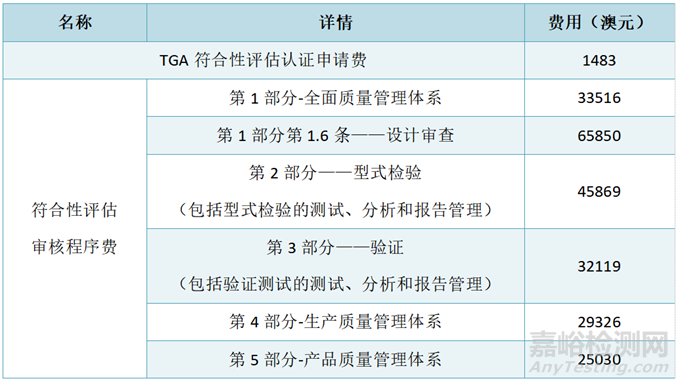
符合性评估费用:若产品没有TGA认可的海外监管/评估机构的市场授权证据,则该产品只能通过TGA进行符合性评估,获得符合性评估证书作为制造商证据。以下表格为符合性评估相关的费用。
年费:年费是对受监管行业征收的一种税收形式,每年征收一次。ARTG中‘Active’的条目(不包括豁免或仅出口),无论该条目随后是否在同一财年内被取消,均自动产生相关财年的年费。比如,纳入ARTG的条目有5个,那么要缴纳五个条目的年费。
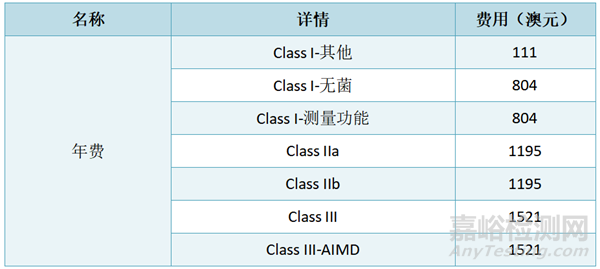
其他收费
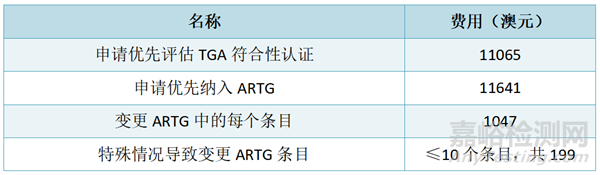
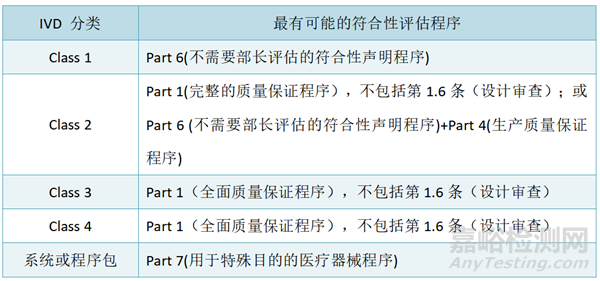
◆ MD医疗器械TGA审核的周期
支付费用后,sponsor将在20个TGA日内收到TGA的通知结果。
若器械被选中审核,将被要求提供更多的支持文件和信息以供审核。TGA并未发布审核所需的具体时间,因为对选中产品的审核时间取决于许多因素,包括:a) 支付审核评估费所需的时间(如适用);b) 提供所需信息所花费的时间;c) 向TGA提供的信息的质量。
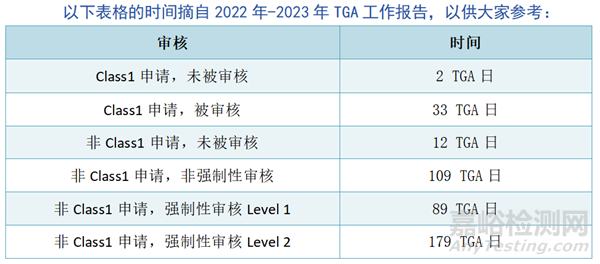
上市认证:纳入ARTG
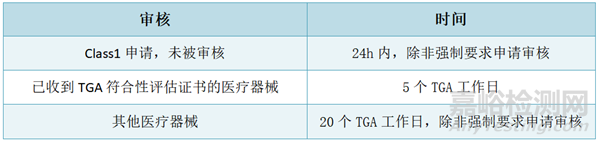
TGA必须在20个TGA工作日内选择一份申请进行审核。TGA为医疗器械(非IVD)的申请审核设定了30至60个工作日的目标时间框架,但有时会超过这些时间框架:
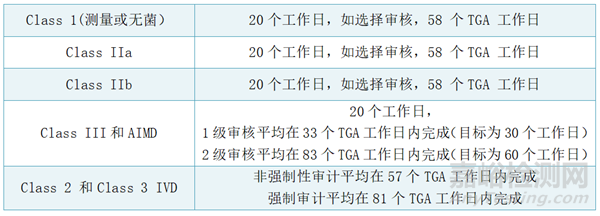
TGA符合性评估官方时间:TGA符合性评估必须要在255个TGA日内完成,不包含问答时间。

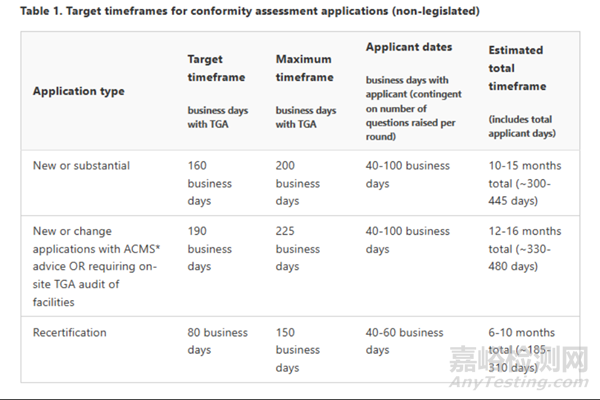
注:澳大利亚MD注册法规、指南更新频繁,都是基于当前澳大利亚的法规、法案、指南编写,若有更新我们将会及时分享。
2、IVD医疗器械市场准入
◆ 澳大利亚IVD医疗器械注册流程图
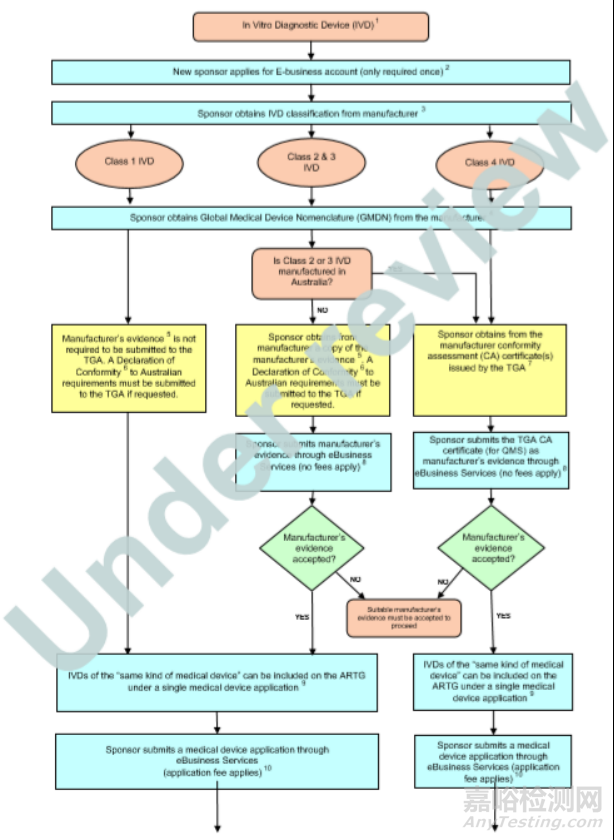
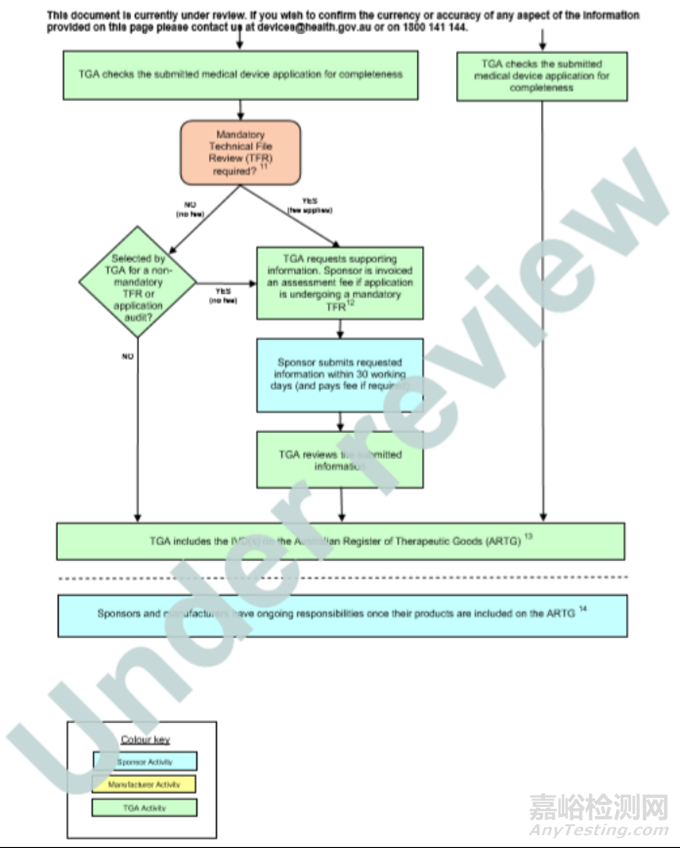
◆ IVD医疗器械注册所需的申请文件和资料
需要提供的资料(产品评估文件,主要是技术文件),必须在通知的时限内提交TGA所需的资料。
提交所需信息的时间限制。
是否需要支付审核评估费。必须在通知的时限内支付审核评估费用。
包括体外诊断医疗器械在内的医疗器械根据基本原则进行评估,并符合其预期目的和基于风险的分类。医疗器械的监管框架涵盖了器械的整个生命周期,包括:
a) 上市前评估:符合性评估
b) 上市认证:ARTG纳入
c) 上市后监督:持续遵守所有监管、安全和性能要求和标准
◆ IVD医疗器械TGA官方费用
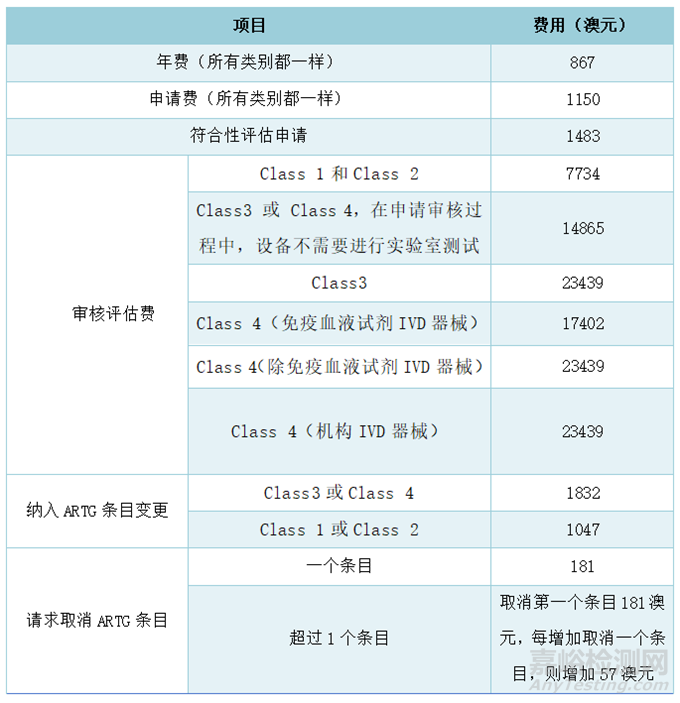
注:若是符合一定条件,TGA可能会减免产品审核评估费用。
◆ 符合性评估初次评估
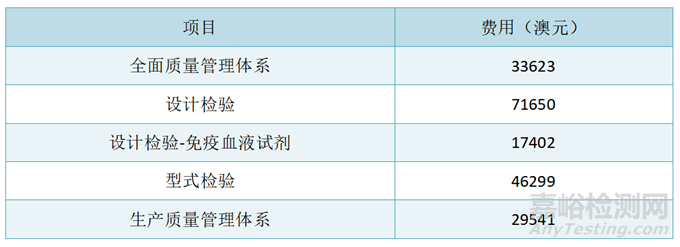
◆ IVD符合性评估程序
法规依据:Therapeutic Goods(Medical Devices)Regulation 2002, Schedule 3
◆ 符合性评估申请流程
①申请人安排和TGA的预提交会议(可选)
②申请人提交TBS申请并支付申请费用
③TGA写信给申请人,提供提交ID并要求提供支持文件,以确定所需的评估级别
④申请人提供所需的支持信息
⑤TGA确定所需的评估级别和发票评估费
⑥申请人支付评估费用
⑦TGA进行评估,包括现场质量体系审核(如适用)
⑧如果符合要求,TGA将颁发合格评定证书
⑨TGA执行持续的监督活动/审计
⑩证书到期前的重新认证
◆ 符合性评估申请文件
1. 体系文件
①最新版本的质量手册副本(根据ISO 13485:2016第4.2.2条的要求)
②组织结构图(如果不是QM的一部分)
③证书范围内产品的产品要求(规格)
④关键供应商名单和如何满足采购要求的说明(ISO 13485:2016,第7.4.1条)
⑤制造设施平面图
⑥关键过程清单及其验证状态(ISO 13485:2016,第7.5.2.1条)。如果产品是无菌供应的,请提供灭菌验证报告的副本
⑦反馈系统程序(ISO 13485:2016,第8.2.1条,上市后要求规定)
⑧咨询通知和不良事件通知的发布和实施程序(ISO 13485:2016,第8.5.1条,治疗产品的统一召回程序)
⑨申请人申请降低评估费的依据文件
2. 技术文件
①器械描述
②器械历史
③基本原则检查表
④风险分析和对照总结
⑤设计和制造信息
⑥临床证据报告
⑦性能评估
⑧产品确认和验证
⑨稳定性
⑩IVD需提供的信息
◆ IVD医疗器械TGA审核的周期
所有合格评定申请,包括体外诊断设备的申请,都需要在255个工作日内处理。
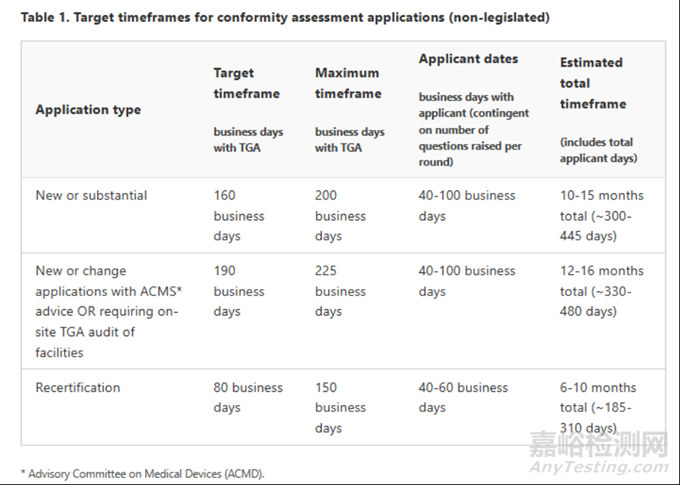
注:澳大利亚IVD注册法规、指南更新频繁,都是基于当前澳大利亚的法规、指南编写,若有更新我们将会及时分享。
六、该区域有关UDI的要求
本节出处为Australian UDI requirements for sponsors and manufacturers
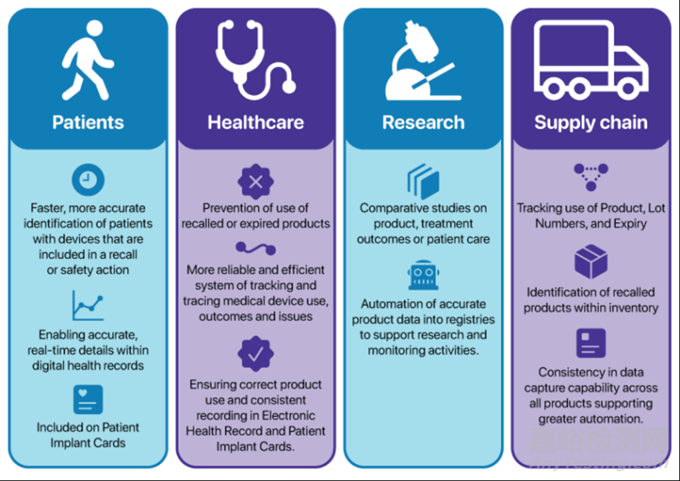
在澳大利亚供应的医疗器械和体外诊断(IVD)设备的赞助商将负责确保其设备具有:设备和所有更高级别的包装上的标签都包含人和机器都可以读取的UDI(如条形码)提交给TGA澳大利亚UDI数据库(AuUDID)的UDI和相关数据UDI与澳大利亚治疗用品注册(ARTG)中的正确纳入相关联UDI数据在设备供应期间得到维护。如有需要,UDI直接标记在设备上。
唯一标识符必须是数字、字母和符号的组合。它还必须遵循TGA认可的UDI颁发机构的规范。
唯一标识符将由两部分组成:
UDI设备标识符(UDI-DI)-标识医疗器械的型号。UDI-DI用作存储在AuUDID中的信息的“访问密钥”。它将用于与设备相关的信息,如不良事件和召回。
UDI-DI的示例包括:GS1 GTIN(全球贸易项目编号)、HIBC-UPN(通用产品编号)、ICCBBA ISBT 128-PPIC(处理器产品标识码)。
UDI生产标识符(UDI-PI)-标识特定于生产的信息,如设备的生产运行。
这可能包括批号、批号或有效期。UDI-PI存在于设备上,但未存储在澳大利亚UDI数据库(AuUDID)中。如果适用,UDI-PI将用于与设备相关的信息,如不良事件和召回。

满足UDI要求的设备,除非另有豁免,否则在澳大利亚供应的医疗器械和体外诊断设备必须符合澳大利亚的UDI要求。设备合规性将基于设备分类。
TGA认可以下发行机构:国际物品编码组织(GS1)、健康产业商业传播委员会(HIBCC)、国际血库自动化共性理事会(ICCBBA)
◆ TGA费用或收费
上传或更改您的UDI信息不收取任何UDI费用。
澳大利亚UDI数据库的持续管理和维护费用包含在年费中。


来源:广东省医疗器械管理学会


