您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-02-24 20:44
当地时间2025年2月20日,加拿大卫生部(Health Canada)更新了《医疗器械许可证申请管理指南(草案)》。这份更新的指南让医疗器械许可证申请过程更加清晰、透明。
1.该指南旨在说明加拿大卫生部如何管理医疗器械许可证(MDL)的申请。
在加拿大,医疗器械按照风险等级分为I到IV类,其中I类代表最低风险,IV类代表最高风险。根据《医疗器械法规》,II、III或IV类医疗器械的制造商必须持有该器械的医疗器械许可证(MDL)或修订后的MDL,才能在加拿大进口或销售。
2.适用范围
本指导文件适用于根据法规第一部分提交的以下类型的MDL申请:
新的和修订的II类申请
新的和修订的(重大变更)III类申请
新的和修订的(重大变更)IV类申请
微小变更申请和
新的和修订的自有品牌申请
3.主要的更新
注册过程的内容基本不变,对整体的框架流程进行了重新调整梳理,使注册的过程更加地清晰明了。
此外,针对复议(Reconsideration process)的过程,新指南增加了流程图,申请表模板等内容,以便利益相关者更好地理解。
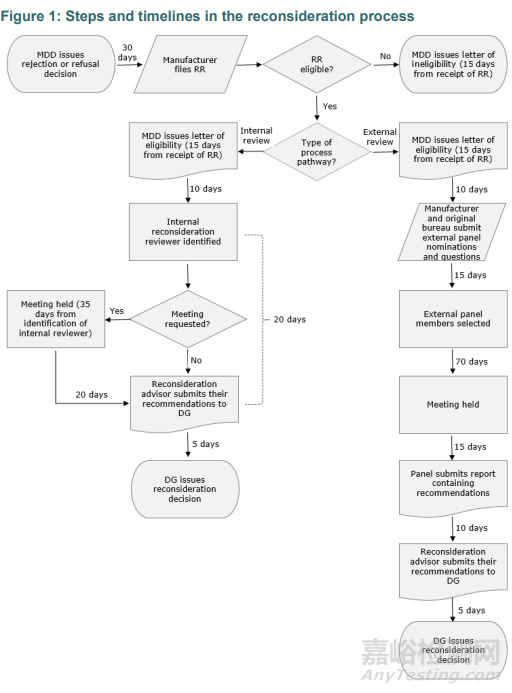
总的来说,注册的流程、时限和内容都基本没有大的变化,只是指南的框架进行了调整,以便利益相关者能更好地了解。目前该指南仍处于草案阶段,加拿大卫生部正在征求利益相关者的意见和建议,以便确定最终的指南文件。

来源:洲通健康科技


