您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-04 09:58
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:14条资讯,阅读时长约:3分钟 」
默克西妥昔单抗在华获批新适应症。默克西妥昔单抗注射液(爱必妥)获国家药监局批准,与铂类和氟尿嘧啶化疗联合,一线治疗复发/转移性头颈部鳞状细胞癌(R/M SCCHN)。这是继西妥昔单抗获批一线治疗RAS基因野生型转移性结直肠癌后又一获批新适应症。西妥昔单抗是全球首款靶向EGFR的IgG1单克隆抗体。在一项Ⅲ期研究中,西妥昔单抗联合铂类化疗显著改善R/M SCCHN患者的无进展生存期(5.5个月vs4.2个月)、总生存期(11.1月vs8.9个月)和客观缓解率(50%vs26.6%)。在安全性方面,西妥昔单抗并没有显著增加化疗的毒副反应。
1.汉森制药卡托普利片通过一致性评价。汉森制药卡托普利片获国家药监局核发的《药品补充申请批件》,该药品通过仿制药一致性评价。卡托普利片为竞争性血管紧张素转换酶抑制剂,临床适应症为高血压、心力衰竭。该药原研药为百时美施贵宝的卡托普利片(CAPOTENTM),最早于1981年获FDA批准上市。目前,该产品国内已获批的企业包括中美上海施贵宝、新华制药、旭东海普药业、罗欣药业等。
2.恒瑞医药SHR2554片/SHR1459片获批临床。恒瑞医药SHR2554片/SHR1459片获国家药监局临床试验通知书,即将开展SHR2554片联合SHR1459片用于治疗标准治疗失败或无标准治疗可用的复发/难治B细胞非霍奇金淋巴瘤的临床试验。SHR2554是一种新型、高效、选择性的口服EZH2抑制剂,拟用于恶性肿瘤的治疗。SHR1459属于BTK选择性小分子抑制剂,在体外和体内实验中均显示出良好的抗B细胞淋巴瘤活性,是治疗B细胞淋巴瘤的潜在疗法。
3.恒瑞PD-1再增一项临床默示许可。3月2日,CDE官网显示恒瑞两款新药获批临床试验。其中,注射用卡瑞利珠单抗新获批的临床试验为联合阿帕替尼或单药一线治疗 PD-L1 表达阳性的复发性或晚期非小细胞肺癌。甲磺酸阿帕替尼片获批的临床试验为联合注射用卡瑞利珠单抗用于一线治疗PD-L1表达阳性(TPS≥1%)且不伴有EGFR/ALK基因突变异常的复发或晚期非小细胞肺癌患者。医药魔方数据库PharmaGo显示,目前,恒瑞注射用卡瑞利珠单抗共登记了66项临床试验,其中III期阶段的有15个。
4.百济神州2019年财报发布。百济神州公布2019年业绩报告。全年收入4.2821亿美元,较2018年的1.9822亿美元同比增长116%;全年产品收入2.226亿美元,较2018年的1.3089亿美元同比增长70%;全年投入研发费用9.2734亿美元,较2018年的6.7901亿美元同比增长36%;销售、一般及行政管理费用为3.8825亿美元,较2018年1.9539亿美元同比增长98%。
1.赛诺菲CD38抗体Sarclisa获FDA批准上市。FDA批准赛诺菲(Sanofi)开发的CD38抗体Sarclisa(isatuximab-irfc)上市,与泊马度胺和地塞米松联用,治疗成年多发性骨髓瘤(MM)患者。这些患者至少接受过两种前期疗法,包括来那度胺和蛋白酶体抑制剂。一项临床试验结果表明,与泊马度胺和低剂量地塞米松相比,isatuximab与泊马度胺和低剂量地塞米松联用将患者的疾病进展和死亡风险降低40%,isatuximab组的中位无进展生存期(11.53个月)是活性对照组(6.47个月)的接近两倍。Isatuximab组患者的总缓解率为60.4%,活性对照组这一数值为35.3%。
2.MorphoSys公司CD19单抗获FDA优先审评资格。MorphoSys公司宣布,FDA已受理其开发的CD19单抗tafasitamab与来那度胺联用,治疗复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)患者的生物制品许可申请,并授予其优先审评资格,预计8月30日前做出回复。一项Ⅱ期临床L-MIND结果显示,tafasitamab联合来那度胺在DLBCL患者中的客观缓解率达60%,完全缓解率达43%。中位随访期17.3个月时,患者的中位无进展生存期为12.1个月。
3.Keytruda经典霍奇金淋巴瘤头对头III期研究击败Adcetris。默沙东PD-1抗体Keytruda治疗复发/难治性经典霍奇金淋巴瘤(cHL)成人患者的Ⅲ期临床KEYNOTE-204获积极结果。患者接受Keytruda单药或Adcetris(brentuximab vedotin)的治疗。根据独立数据监控委员会的中期分析,Keytruda治疗组与Adcetris治疗组相比,患者在PFS上显示出统计学意义的显著改善。该试验将继续评估治疗效果及其他指标。Keytruda的安全性与先前报道的研究一致,未发现新的安全性信号。Adcetris是一种抗体-药物偶联物(ADC)药物,来自Seattle Genetics公司。
4.Karyopharm公司创新口服疗法达到Ⅲ期临床终点。Karyopharm公司宣布,其开发的口服选择性核输出抑制剂Xpovio(selinexor),与Velcade 和地塞米松联合,在治疗难治性多发性骨髓瘤患者的Ⅲ期临床试验BOSTON中,达到主要研究终点。与Velcade+地塞米松的活性对照组相比,加入Xpovio的联合疗法显著降低患者疾病进展或死亡的风险。治疗组和活性对照组中患者的中位无进展生存期分别为13.93个月和9.46个月。详细数据将于医学会议上公布。
5.吉利德收购Forty Seven公司。吉利德宣布拟斥资约49亿美元收购生物技术公司Forty Seven。Forty Seven公司由斯坦福大学Irv Weissman教授创建于2015年,专注于开发CD47抗体药物。该公司主打在研抗CD47单抗magrolimab在治疗不同血液癌症的临床试验中已经表现出良好的疗效。在一项评估magrolimab联合azacitidine治疗不适合化疗的高风险骨髓增生异常综合症(MDS)患者和初治急性髓系白血病(AML)患者的Ⅰb期临床中,该组合疗法在MDS患者中的总缓解率(ORR)达到92%,在AML患者中的ORR达到64%。此外,Magrolimab还可能成为改变造血干细胞移植手术范式的重要手段。
6.Immunocore公司完成B轮融资。专注于T细胞受体(TCR)疗法的生物技术公司Immunocore完成1.3亿美元B轮融资。本轮融资将用于扩展和加快其ImmTAX™平台三个肿瘤项目的开发,包括与基因泰克合作的IMC-C103C(靶向MAGE-A4),与GSK合作的GSK01(靶向NY-ESO-1),以及其首款候选药物Tebentafusp(IMCgp100)。目前,Tebentafusp作为转移性葡萄膜黑色素瘤患者的潜在治疗方法,正在进行关键性临床研究。本轮融资还将用于推进针对慢性乙肝和PRAME(一个在多种肿瘤中表达的抗原)的两个项目的开发,并加速治疗自身免疫疾病(与JDRF合作)新型平台的开发等。
1.钟南山团队建议“早期筛查”等防控措施实施至4月底。中国工程院院士钟南山团队近日在《JournalofThoracicDisease》期刊发表“基于SEIR优化模型和AI对公共卫生干预下的中国COVID-19(新冠肺炎)暴发趋势预测”的研究文章。该研究把1月23日前后的人口迁徙数据以及最新的COVID-19流行病学数据整合到经典传染病学预测模型(SEIR)中并得出流行曲线。推测本次疫情中国在2月下旬达到高峰,4月底趋于平缓。并建议严格的防控措施如“早期筛查”最好实施至2020年4月底。
2.湖北发布疫情风险等级评估报告。湖北省首次发布《湖北省县(市、区)新冠肺炎疫情风险等级评估报告》,按低风险、中风险、高风险3个等级对所有103个县(市、区)进行等级评估。其中,无确诊病例或连续14天无新增确诊病例为低风险地区;14天内新增确诊病例不超过50例,或累计确诊病例超过50例,14天内未发生聚集性疫情为中风险地区;累计病例超过50例,14天内有聚集性疫情发生为高风险地区。截至2020年2月28日24时,全省低风险县(市、区)11个,中风险县(市、区)34个,高风险县(市、区)58个。
3.新冠肺炎疫情期间,网上复诊医保可报销。国家医保局、国家卫健委联合印发《关于推进新冠肺炎疫情防控期间开展“互联网+”医保服务的指导意见》,明确常见病、慢性病患者在符合条件的互联网医疗机构复诊,诊疗费和药费可依规进行医保报销。互联网医疗机构为参保人在线开具电子处方,线下采取多种方式灵活配药,参保人可享受医保支付待遇。诊疗费和药费医保负担部分在线直接结算,参保人仅需负担自付部分。
【新华制药】“依达拉奉注射液”获得药品注册批件,用于改善急性脑梗塞所致的神经症状、日常生活活动能力和功能障碍。经查询,除新华制药外,目前国内有包括原研日本田边三菱制药、先声药业、吉林博大制药等多家企业获批上市及销售。经查询相关数据库,依达拉奉注射液2018年全球销售额约为6.6亿美元,2018年国内147城市医院用药销售额约为12.8亿元。
【紫鑫药业】截止2020年3月2日,公司控股股东康平公司与其一致行动人仲维光及仲桂兰减持数量已过半。康平公司共减持1249.52万股(总股本0.98%),仲桂兰共减持2787万股(总股本2.18%)。
【圣达生物】公司及公司下属子公司2019年7月1日至2020年3月2日累计收到政府补助资金人民币495.30万元(数据未经审计)。
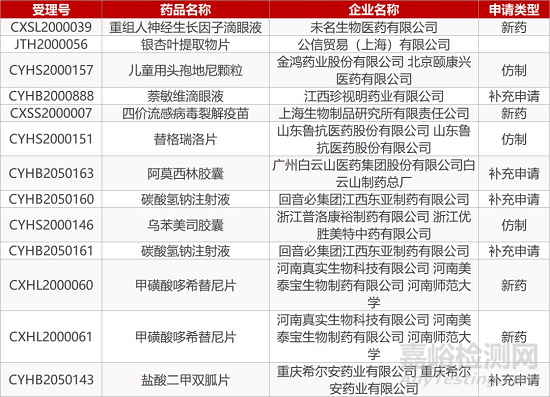
2. FDA最新获批情况(北美3月2日)

- The End -

来源:药研发


