您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-29 09:13
美国食品药品管理局(FDA)2020年1~6月期间通过上市前批准(PMA)途径批准了25种医疗器械,其中13种为拓展适应症的医疗器械。在此期间无通过人道主义豁免(HDE)途径批准的医疗器械。
拓展适应症的医疗器械
2020年1~6月FDA新批准拓展适应症的13种医疗器械中,有2种神经刺激设备,2种血管支架,5种用于癌症诊断的实验室检测产品,1种人工晶状体,1种人工耳蜗,1种椎间盘置换设备,1种用于面部填充。
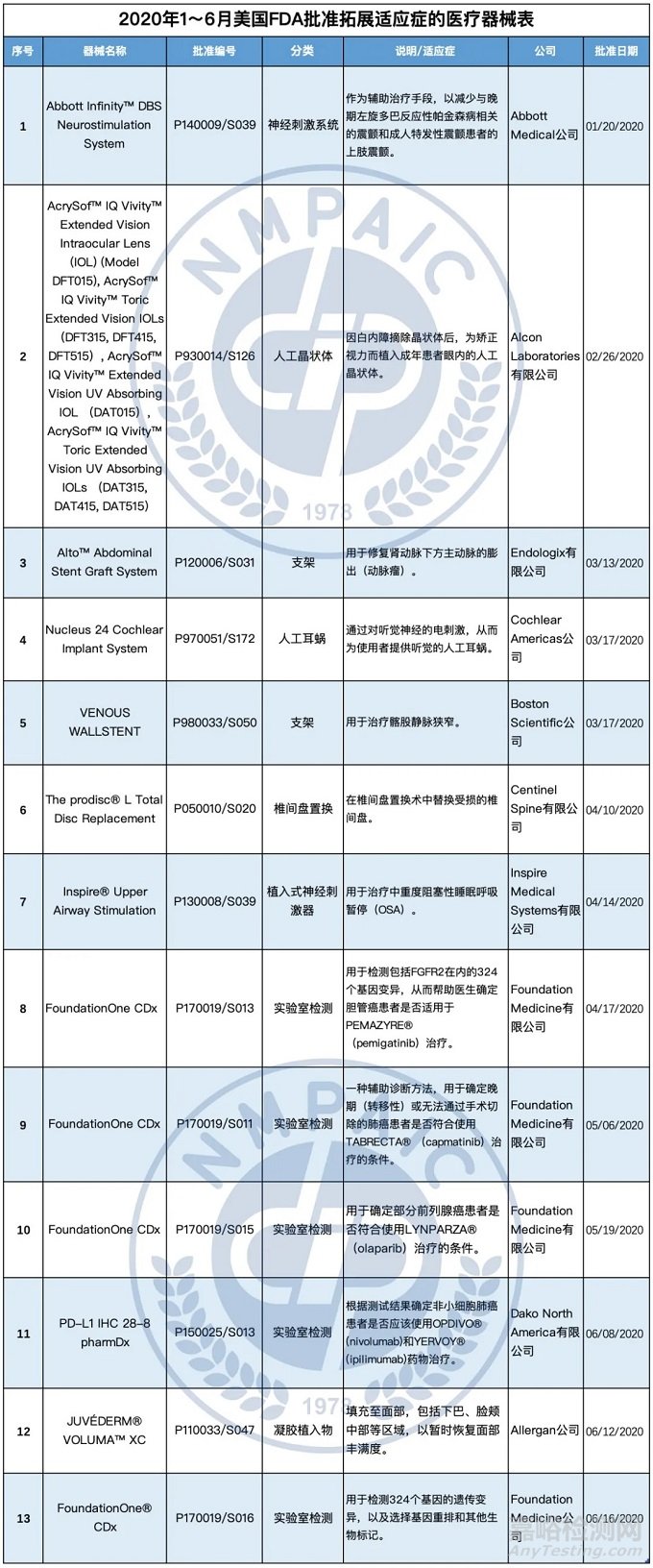
这些拓展适应症的医疗器械,审批途径均为上市前批准(PMA),产品的具体介绍如下:
01
Abbott Medical公司的Abbott InfinityTM DBS Neurostimulation System产品
该产品是一种植入式装置,通过振幅、脉冲宽度和频率的不同组合,将低强度电脉冲传送到大脑的神经中枢。植入体内的脉冲发生器通过导线(电线)向大脑发送电脉冲,以减少震颤和不自主的肌肉运动。患者可以通过基于APP的控制器来管理电流的强度和频率。
对于药物未能充分控制的晚期左旋多巴反应性帕金森病患者来说,此次PMA补充扩大了使用该装置的适应症,相比于之前,在患者大脑中植入的位置现在有了额外的选择。
02
Alcon Laboratories公司的AcrySofTM IQ VivityTM Extended Vision Intraocular Lens (IOL) (Model DFT015), AcrySofTM IQ VivityTM Toric Extended Vision IOLs (DFT315, DFT415, DFT515), AcrySofTM IQ VivityTM Extended Vision UV Absorbing IOL (DAT015), AcrySofTM IQ VivityTM Toric Extended Vision UV Absorbing IOLs (DAT315, DAT415, DAT515)产品
该产品是因白内障摘除晶状体后,为矫正视力而植入成年患者眼内的人工晶状体。
本次PMA补充扩展了使用范围,以改善中距离视觉(例如用电脑工作、化妆或剃须)和近距离视觉(例如阅读、写作和缝纫)。
03
Endologix公司的AltoTM Abdominal Stent Graft System产品
该产品由三部分组成:植入物(支架)、延伸植入物(支架内的管子)和导管。使用时将导管通过小切口插入股动脉,通过导管将支架引导至动脉瘤的位置,然后释放支架并将之扩展到主动脉大小,为血液流通提供通道,从而预防动脉瘤的进一步恶化和破裂。
本次补充批准的原因是厂家对植入物和导管的设计进行了修改。
04
Cochlear Americas公司的Nucleus 24 Cochlear Implant System产品
该产品由一个内部组件和一个外部组件组成,前者由外科医生植入,后者由患者佩戴于体外。声音通过外部组件的麦克风被接收转换为编码信号并传递至内部组件,内部组件解释这些信号并转化为电刺激作用于听觉神经,使患者产生听觉。
本产品此前被批准用于12个月以上的患者,本次修改扩大了适用人群,9到12个月大的双耳重度听觉丧失儿童也被纳入适用范围。
05
Boston Scientific公司的VENOUS WALLSTENT产品
该产品由两部分组成:编制金属线制成的支架和导管系统。使用时,医生将导管插入狭窄的髂股静脉,并通过其将支架输送至狭窄处。支架一旦离开导管就会自动膨胀,从而打开狭窄的血管,增加腿部血流。
该产品此前被批准用于治疗中央静脉狭窄,本次批准扩大了支架的适用范围,批准其用于髂股静脉狭窄。
06
Centinel Spine公司的The prodisc® L Total Disc Replacement产品
该产品由三部分组成:两个由钴铬合金制成的终板和一个超高分子量聚乙烯构成的镶嵌材料。其通过手术植入退行性椎间盘疾病患者的腰椎(L3-S1),从而恢复椎骨之间的自然距离及腰椎的正常运动。
本次批准扩大了该产品的适用范围,包括治疗L3-S1的两个连续的腰椎节段。
07
Inspire Medical Systems公司的Inspire® Upper Airway Stimulation (UAS)产品
该产品是一种用于治疗中重度阻塞性睡眠呼吸暂停(OSA)的植入式神经刺激器。其由几个组件组成,包括植入式脉冲发生器(IPG)、刺激引线、传感引线和外部组件(如医生编程器和患者编程器)。使用时通过植入式脉冲发生器检测患者的呼吸模式,并通过轻微的神经刺激维持气道通畅。医生可以使用外部医生编程器进行刺激设置。患者睡眠遥控器允许患者在入睡前打开治疗,醒来时关闭治疗。
本次批准扩展了该产品的适应症,用于18至21岁患有中重度OSA的患者。
08
Foundation Medicine公司的FoundationOne CDx产品
该产品是一种实验室检测方法,用于检测包括FGFR2在内的324个基因变异,从而帮助医生确定晚期(转移性)胆管癌或不能手术切除的胆管癌患者是否适用于PEMAZYRE® (pemigatinib)治疗。医生对患者的肿瘤组织进行切片取样,然后将制备好的样本送至Foundation Medicine公司进行检测,之后公司会将检测结果回馈给医生和患者。
本次批准扩大了该产品的适用范围,主要是FGFR2基因发生变异的胆管癌患者。
09
Foundation Medicine公司的FoundationOne CDx产品
该产品是一种辅助诊断方法,用于确定晚期(转移性)或无法通过手术切除的肺癌患者是否符合使用TABRECTA®(capmatinib)治疗的条件。医生从患者的肺部肿瘤组织中取出组织样本,然后将制备好的样本送至Foundation Medicine公司进行检测。Foundation Medicine公司从肿瘤组织切片中分离出DNA,然后与检测和分析DNA序列的化学物质(试剂)混合,对患者的DNA序列进行评估,以确定MET基因是否存在某些突变。若存在突变,则患者可以接受TABRECTA®(capmatinib)治疗。
该产品此前被批准用于检测非小细胞肺癌、黑色素瘤、乳腺癌、结直肠癌和卵巢癌患者的基因变异。此次PMA批准扩大了该产品的适应症,包括肿瘤组织中MET基因发生某些基因突变的肺癌患者。
10
Foundation Medicine公司的FoundationOne CDx产品
该产品是一种实验室检测方法,其检测结果用于确定部分前列腺癌患者是否符合使用LYNPARZA®(olaparib)治疗的条件。医生从患者的前列腺癌肿瘤组织中取少量的样本,送至Foundation Medicine公司进行检测。Foundation Medicine公司从肿瘤细胞中分离出DNA,并与化学物质(试剂)混合,以检测和分析HRR基因是否突变。若存在突变,则患者可以接受LYNPARZA®(olaparib)治疗。该产品此前被批准用于检测非小细胞肺癌、黑色素瘤、乳腺癌、结直肠癌和卵巢癌患者的基因变异。此次PMA批准扩大了该产品的适应症,将HRR基因发生某些突变的前列腺癌患者纳入其中。
11
Dako North America公司的PD-L1 IHC 28-8 pharmDx产品
该产品是一种实验室检测方法。实验室使用该产品对癌组织切片进行处理,如果切片中含有PD-L1蛋白,就会被染成深褐色,则非小细胞肺癌患者可以接受OPDIVO® (nivolumab)和YERVOY® (ipilimumab)药物治疗。
该产品此前被批准用于在非鳞状肺癌、尿路上皮细胞癌和头颈部鳞状细胞癌患者中识别PD-L1蛋白,以确定患者是否符合进行OPDIVO® (nivolumab)药物治疗的条件。此次PMA批准扩大了该产品的适应症,用于确定非小细胞肺癌患者是否应接受OPDIVO® (nivolumab)和YERVOY® (ipilimumab)药物治疗。
12
Allergan公司的JUVÉDERM® VOLUMA™ XC产品
该产品是一种注射到面部组织特定区域的凝胶植入物(真皮填充物)。它由链球菌属细菌所制造的交联透明质酸(HA)组成,以0.3%的利多卡因作为麻醉剂配制成20 mg·mL-1的浓度。
该产品此前被批准用于注射到面部组织中,以暂时恢复面部中部的丰满度,包括脸颊和脸部中部附近的区域。此次PMA批准将应用范围扩大至下巴区域。
13
Foundation Medicine公司的FoundationOne® CDx产品
该产品是一种辅助诊断,用于实验室检测324个基因的遗传变异,以及在肿瘤的基因组组成中选择基因重排和其他生物标志物(如:肿瘤突变负荷)。
该产品最初被批准用于检测患者的基因突变,存在这些基因突变的患者可能受益于FDA批准的用于非小细胞肺癌、黑色素瘤、乳腺癌、结直肠癌和卵巢癌的15种治疗方法中的一种。此次PMA批准扩大了适应症,包括了高肿瘤突变负荷(TMB)的实体肿瘤患者。识别高TMB水平的肿瘤将帮助实体肿瘤患者通过KEYTRUDA®(pembrolizumab)获得个性化治疗。

来源:国家药品监督管理局信息


