您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-24 18:32
2017年至今,CMDE陆续在官网上发布部分医疗器械、体外诊断试剂的产品注册技术审评报告。目前,已发布的IVD产品审评报告共24个,包括23个三类、1个进口二类。本文将体外诊断(IVD)产品注册技术审评报告整理汇总,欢迎收藏查阅。
体外诊断(IVD)产品
人类EGFR突变基因检测试剂盒(多重荧光PCR法)(CSZ1700057)
发布时间:2018-1-15
产品管理类别:三类 6840
申请人名称 :厦门艾德生物医药科技股份有限公司
产品预期用途:
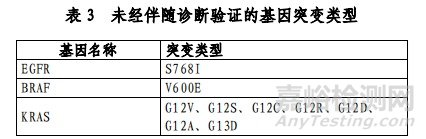
本试剂盒用于体外定性检测晚期非小细胞肺癌(NSCLC)患者血浆 DNA 样本中人类EGFR 突变基因。其中 19 外显子缺失、L858R 突变用于盐酸埃克替尼片的伴随诊断检测,T790M 突变用于甲磺酸奥希替尼片的伴随诊断检测(具体可参照表 2)。血浆 EGFR 检测敏感度尚不能达到组织样本检测水平,因此推
荐用于晚期NSCLC 患者,且作为不易获取 NSCLC 组织样本时的补充手段。如可以获得病理组织时,建议优先考虑病理组织检测结果。
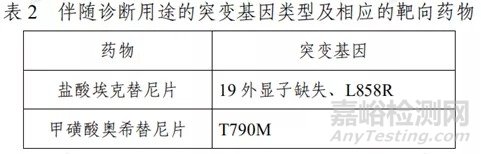
注:甲磺酸奥希替尼片的功效尚未在 EGFR T790M 血浆样本检 测结果阳性、同时肿瘤组织样本检测结果阴性或未知群体中确定。
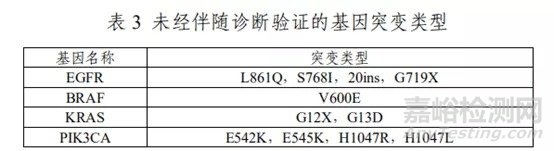
下表3中为本试剂盒可以检出,但 EGFR 相关药物安全性和有效性尚未确定的 EGFR 突变基因类型。

本试剂盒仅用于对 NSCLC 患者靶基因序列的检测,其检测结果仅供临床参考,不应作为患者个体化治疗的唯一依据,临床医生应结合患者病情、药物适应症、治疗反应及其他实验室检测指标等因素对检测结果进行综合判断。
风疹病毒IgG抗体检测试剂(荧光免疫层析法)(CSZ1700071)
发布时间:2018-02-23
产品管理类别:三类 6840
申请人名称:广州万孚生物技术股份有限公司
产品预期用途:
本试剂用于体外定性检测人血清或血浆中的风疹病毒IgG 抗体。在临床上用于风疹病毒感染的辅助诊断。
麻疹病毒IgG抗体检测试剂(荧光免疫层析法)(CSZ1700073)
发布时间:2018-02-23
产品管理类别:三类 6840
申请人名称:广州万孚生物技术股份有限公司
产品预期用途:
本试剂用于体外定性检测人血清或血浆中的麻疹病毒 IgG 抗体。在临床上用于麻疹病毒感染的辅助诊断。
miR-92a检测试剂盒(荧光RT-PCR法)(CSZ1600116)
发布时间:2018-03-23
产品管理类别:三类
申请人名称:深圳市晋百慧生物有限公司
产品预期用途:
该产品用于体外定性检测人粪便样本中的 miR-92a 核酸。
该产品用于便潜血阳性、综合其他症状如排便习惯改变、大便形状变化、慢性便秘、排便里急后重等经临床医生诊断建议肠镜检查同时由于不同原因拒绝进行肠镜检查的患者,用于临床对大肠癌的辅助诊断。检测结果阳性不作为大肠癌早期诊断或确诊的证据,检测结果阴性也不能排除大肠癌的可能,患者最终诊断应依据肠镜检查结果。该产品不用于普通人群的肿瘤筛查。
大肠癌按《恶性肿瘤 TNM 分类法》分为 0 期,I 期,II期,III 期,IV 期,早期一般呈现如排便习惯改变、大便形状变化、大便带血、慢性便秘、排便里急后重等症状,但常因症状轻微和不典型而被忽视。miR-92a 来自人类 13 号染色体上的 miR-17-92 基因簇,是一类小分子非编码 RNA。miR-92a 通过靶向抑制 PTEN、KLF4和下游的 p21 基因,可促进大肠癌细胞的增殖和迁移。研究发现,在大肠癌患者粪便样本中 miR-92a 含量特征性增高。
丙型肝炎病毒核酸测定试剂盒(PCR-荧光探针法)(CSZ1700055)
发布时间:2018-04-16
产品管理类别:三类 6840
申请人名称:北京纳捷诊断试剂有限公司
产品预期用途:
本试剂盒用于体外定量测定血清样本中的丙型肝炎病毒(HCV)核酸(RNA),适用于需要进行HCV 感染检测的患者和接受抗病毒治疗的丙型肝炎患者。
本试剂盒可以检测 HCV 1~6 型临床常见型别,主要通过对丙型肝炎患者血液中 HCV RNA 含量及变化情况的监测,用于评估抗病毒治疗的应答和治疗效果。该检测不得作为患者病情评价的唯一指标,必须结合临床表现和其他实验室检测指标对患者病情进行综合评价。本试剂盒不得用于 HCV 的血源筛查。
人EGFR、KRAS、BRAF、PIK3CA、ALK、ROS1基因突变检测试剂盒(半导体测序法)(CSZ1700089)
发布时间:2018-08-03
产品管理类别:第三类
申请人名称:天津诺禾致源生物信息科技有限公司
产品预期用途:
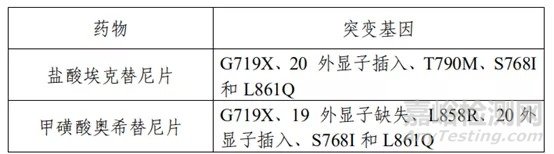
该产品用于定性检测非小细胞肺癌(NSCLC)肿瘤组织福尔马林固定石蜡包埋切片(FFPE)样本中 EGFR、KRAS、BRAF、PIK3CA、ALK、ROS1 基因的多种变异。其中EGFR基因的 L858R 及 19 号外显子缺失(19del)突变用于吉非替尼片的伴随诊断检测,T790M 突变用于甲磺酸奥希替尼片的伴随诊断检测,ALK 融合和 ROS1 融合用于克唑替尼胶囊的伴随诊断检测(具体可参照表 2)。
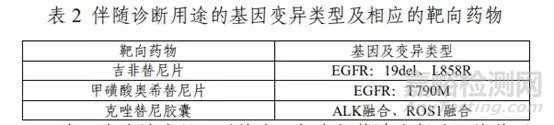
表 3 中为该产品可以检出,但未经伴随诊断验证的基因突变类型。
其检测结果仅供临床参考,不应作为患者个体化治疗的唯一依据。临床医生应结合患者病情及其他实验室检测指标等因素对检测结果进行综合判断。
EGFR_ALK_ROS1_BRAF_KRAS_HER2基因突变检测试剂盒(可逆末端终止测序法)(CSZ1800026)
发布时间:2018-09-26
产品管理类别:第三类
申请人名称:南京世和医疗器械有限公司
产品预期用途:
本试剂盒用于定性检测非小细胞肺癌(NSCLC)患者经福尔马林固定的石蜡包埋(FFPE)组织样本中 EGFR、ALK、ROS1、BRAF、KRAS、HER2 基因的多种变异。其中,EGFR基因 19 外显子缺失及L858R 点突变用于吉非替尼片及盐酸埃克替尼片的伴随诊断检测,T790M 点突变用于甲磺酸奥希替尼片的伴随诊断检测;ALK 基因融合和 ROS1 基因融合用于克唑替尼胶囊的伴随诊断检测(具体可参考表 2)。
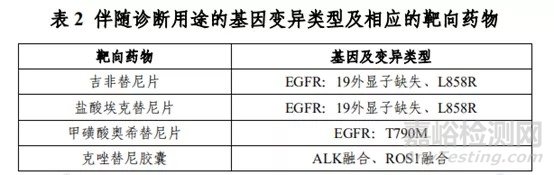
表 3 中为本试剂盒可以检出,但未经伴随诊断验证的基因突变类型。

其检测结果仅供临床参考,不应作为患者个体化治疗的唯一依据。临床医生应结合患者病情及其他实验室检测指标等因素对检测结果进行综合判断。
人类SDC2基因甲基化检测试剂盒(荧光PCR法)(CSZ1800035)
发布时间:2018-11-13
产品管理类别:三类 6840
申请人名称:广州市康立明生物科技有限责任公司
产品预期用途:
该产品用于体外定性检测人粪便样本中 SDC2 基因的甲基化情况。
该产品适用于临床医生建议做肠镜检查的患者的辅助诊断,不能作为肿瘤早期诊断或确诊的依据,仅作为辅助诊断供临床医生参考,提供给患者更多一种大肠癌辅助诊断方法的选择。临床医生应结合患者病情及其他实验室检测指标等因素对检测结果进行综合判断。
结核分枝杆菌复合群核酸检测试剂盒(恒温扩增荧光法)(CSZ1700171)
发布时间:2019-5-13
产品管理类别:三类
申请人名称:广州迪澳生物科技有限公司
产品预期用途:
本试剂盒用于体外定性检测人痰液样本中的结核分枝杆菌复合群脱氧核糖核酸(DNA)。本产品用于结核病的辅助诊断。
甲型_乙型流感及呼吸道合胞病毒核酸联合检测试剂盒(实时荧光PCR法)(JSZ1800082)
发布时间:2019-8-25
产品管理类别:三类
申请人名称:美国赛沛公司 Cepheid
产品预期用途:
美国赛沛公司Cepheid本产品用于体外定性检测人鼻咽拭子中的甲型流感病毒、乙型流感病毒和呼吸道合胞病毒(RSV)RNA。
人类10基因突变联合检测试剂盒(可逆末端终止测序法)(CSZ1700127)
发布时间:2018-11-12
产品管理类别:三类
申请人名称:厦门艾德生物医药科技股份有限公司
产品预期用途:
本试剂盒用于定性检测非小细胞肺癌(NSCLC)、结直肠癌(CRC)患者经中性福尔马林固定的石蜡包埋(FFPE)的组织样本中EGFR/ALK/ROS1/RET/KRAS/NRAS/PIK3CA/BRAF/HER2/MET基因变异。其中,针对NSCLC,EGFR基因中:19号外显子缺失(19del)、L858R点突变用于吉非替尼片的伴随诊断检测,T790M点突变用于甲磺酸奥希替尼片的伴随诊断检测;ALK基因重排(融合)和ROS1基因重排(融合)用于克唑替尼胶囊的伴随诊断检测;针对CRC,KRAS基因野生型用于西妥昔单抗注射液的伴随诊断检测;如表2所示。
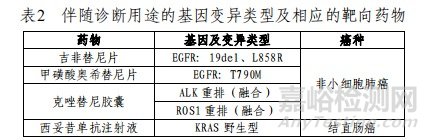
表3中为本试剂盒可以检出,但未经伴随诊断验证的基因变异类型。
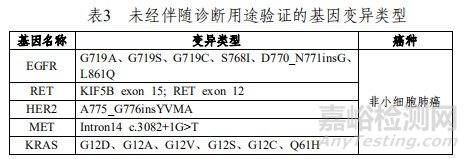

其检测结果仅供临床参考,不应作为患者个体化治疗的唯一依据。临床医生应结合患者病情及其他实验室检测指标等因素对检测结果进行综合判断。
PD-L1检测试剂盒(免疫组织化学法)(JSZ1800077)
发布时间:2019-8-14
产品管理类别:三类
申请人名称:美国丹科北美有限公司 Dako North America, Inc.
产品预期用途:
本试剂盒用于定性检测中性福尔马林固定石蜡包埋(FFPE的非小细胞肺癌(NSCLC)组织中的 PD-L1 蛋白,辅助鉴别可使用 KEYTRUDA®(pembrolizumab 帕博利珠单抗)治疗的 NSCLC 患者。
水通道蛋白抗体(AQP4 Ab)检测试剂盒(酶联免疫法)(JSZ1800016)
发布时间:2019-9-24
产品管理类别:二类 6840
申请人名称:RSRLimited
产品预期用途:
用于体外半定量检测人血清中水通道蛋白抗体(AQP4 Ab) 的含量。
PD-L1检测试剂盒(免疫组织化学法)(JSZ1800126)
发布时间:2019-9-24
产品管理类别:三类
申请人名称:美国丹科北美有限公司 Dako North America, Inc.
产品预期用途:
本试剂盒用于定性检测经福尔马林固定石蜡包埋(FFPE)的非鳞状非小细胞肺癌(nsNSCLC)组织中的 PD-L1 蛋白,检出的非鳞状非小细胞肺癌患者样本中的 PD-L1 表达(≥1%)可能与使用 OPDIVO®(纳武利尤单抗,nivolumab)后的生存期延长相关。
结核分枝杆菌特异性细胞免疫反应检测试剂盒(酶联免疫法)(CSZ1900135)
发布时间:2019-12-9
产品管理类别:三类
申请人名称:广州市雷德生物科技有限公司
产品预期用途:
本产品用于体外定性检测人新鲜外周静脉抗凝血中结核分枝杆菌特异性的 T 细胞免疫反应。
本产品用于临床结核病的辅助诊断。
结核分枝杆菌复合群核酸检测试剂盒(恒温扩增-实时荧光法)(CSZ1900160)
发布时间:2019-12-13
产品管理类别:第三类 (6840)
申请人名称:杭州优思达生物技术有限公司
产品预期用途:
本试剂盒适用于体外定性检测人痰液样本中的结核分枝杆菌复合群(MTC)脱氧核糖核酸(DNA)。
结核分枝杆菌特异性细胞因子检测试剂盒 (酶联免疫法)(CSZ1700172)
发布时间:2020-1-3
产品管理类别:第三类 (6840)
申请人名称:广州迪澳医疗科技有限公司
产品预期用途:
本产品用于体外定性检测人新鲜外周静脉抗凝全血分离的淋巴细胞中结核分枝杆菌特异性的 T 细胞免疫反应。本产品用于结核病的辅助诊断。
RNF180 Septin9基因甲基化检测试剂盒(PCR荧光探针法)(CSZ1900136)
发布时间:2020-4-24
产品管理类别:第三类 (6840)
申请人名称:博尔诚(北京)科技有限公司
产品预期用途:
该产品用于体外定性检测人血浆中甲基化的 RNF180 及Septin9 基因。
该产品适用于经临床医师诊断建议胃镜检查同时由于患者个人原因拒绝进行胃镜检查的患者。检测结果阳性不作为胃癌早期诊断或确诊的证据,检测结果阴性也不能排除胃癌的可能,患者最终诊断应依据胃镜检查结果。该产品不用于普通人群的肿瘤筛查。基于现有研究,仅限于有胃癌家族史者或 40 岁以上胃癌高风险人群检测。
人EGFR KRAS BRAF HER2 ALK ROS1基因突变检测试剂盒(半导体测序法)(CSZ1900047)
发布时间:2020-1-13
产品管理类别:第三类 (6840)
申请人名称:厦门飞朔生物技术有限公司
产品预期用途:
本试剂盒用于定性检测非小细胞肺癌(NSCLC)患者经福尔马林固定的石蜡包埋(FFPE)组织样本中 EGFR/KRAS/BRAF/HER2/ALK/ROS1 基因突变。其中,EGFR 基因 19 外显子缺失及 L858R 点突变用于吉非替尼片、盐酸埃克替尼片的伴随诊断检测;ALK 基因融合用于克唑替尼胶囊的伴随诊断检测(表 2);其余 19 个突变位点为本试剂盒可以检出,但未经伴随诊断验证的基因突变类型(表 3)。
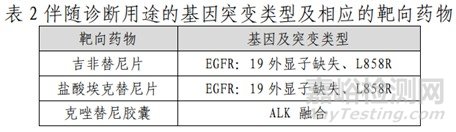
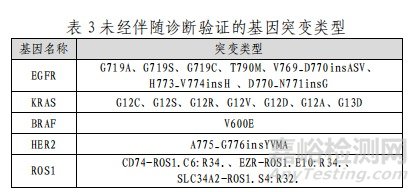
其检测结果仅供临床参考,不应作为患者个体化治疗的唯一依据。临床医生应结合患者病情及其他实验室检测指标等因素对检测结果进行综合判断。
遗传性耳聋基因检测试剂盒(联合探针锚定聚合测序法)(CSZ1900042)
发布时间:2020-4-16
产品管理类别:第三类 (6840)
申请人名称:华大生物科技(武汉)有限公司
产品预期用途:
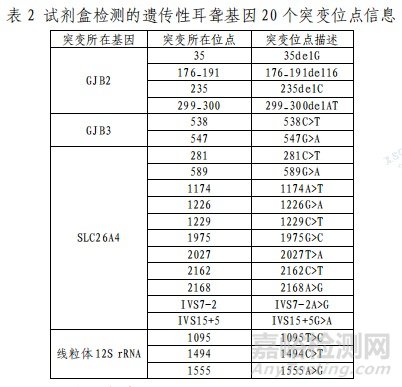
本试剂盒用于体外定性检测干血片样本中人基因组 DNA的 4 个遗传性耳聋基因的 20个位点的突变(见表 2),检测结果用于耳聋的辅助诊断,本产品用于构建测序文库。检测结果仅代表对相关位点的检测,不作为患者是否有遗传性耳聋倾向的诊断和排除的唯一标准,如需确诊病例,请结合临床症状及其他检测手段进行综合评估。
胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(半导体测序法)(CSZ1900377)
发布时间:2020-8-17
产品管理类别:第三类 (6840)
申请人名称:东莞博奥木华基因科技有限公司
产品预期用途:
本试剂盒用于定性检测孕周为12+0周及以上的孕妇外周血血浆中胎儿游离脱氧核糖核酸(DNA),通过分析样本中的胎儿游离 DNA 的 21 号、18 号及 13 号染色体数量的差异,对胎儿染色体非整倍体疾病 21-三体综合征、18-三体综合征和 13-三体综合征进行产前筛查。本试剂盒仅用于构建测序文库。
人EGFR_ALK_BRAF_KRAS基因突变联合检测试剂盒(可逆末端终止测序法)(CSZ1700157)
发布时间:2018-7-13
产品管理类别:第三类 (6840)
申请人名称:广州燃石医学检验所有限公司
产品预期用途:
本试剂盒用于定性检测非小细胞肺癌(NSCLC)患者经福尔马林固定的石蜡包埋(FFPE)的组织标本中 EGFR /ALK /BRAF /KRAS 基因变异。其中,EGFR 基因中:19 号外显子缺失(19del)、L858R点突变用于吉非替尼片、盐酸埃克替尼片伴随诊断检测,T790M 点突变用于甲磺酸奥希替尼片的伴随诊断检测;ALK 基因中:ALK 重排(融合)用于克唑替尼胶囊的伴随诊断检测(具体可参照表2)。
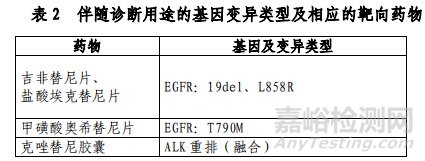
表 3 中为本试剂盒可以检出,但未经伴随诊断验证的基因突变类型.
其检测结果仅供临床参考,不应作为患者个体化治疗的唯一依据。临床医生应结合患者病情及其他实验室检测指标等因素对检测结果进行综合判断。
胚胎植入前染色体非整倍体检测试剂盒(半导体测序法)(CSZ1900093)
发布时间:2019-12-2
产品管理类别:第三类 (6840)
申请人名称:苏州贝康医疗器械有限公司
产品预期用途:
本产品用于定性检测试管婴儿过程中体外培养胚胎的囊胚滋养层细胞的脱氧核糖核酸(DNA),通过对胚胎部分细胞的 DNA 进行检测,分析胚胎染色体是否存在非整倍体数量异常,辅助临床医生判断胚胎是否植入,本产品用途为构建测序文库。
本产品适用于女性年龄 35 岁及以上进行试管婴儿的患者;夫妻双方或一方存在染色体异常的患者;三次以上的试管婴儿植入失败者;三次以上自然流产患者;生育过染色体异常患儿的夫妇。
检测结果仅供参考,不单独作为确诊的依据,本产品不用于拷贝数变异的检测。
KRAS 基因突变及 BMP3NDRG4 基因甲基化和便隐血联合检测试剂盒(PCR 荧光探针法-胶体金法)(CSZ2000050)
发布时间:2020-11-2
产品管理类别:第三类 (6840)
申请人名称:杭州诺辉健康科技有限公司
产品预期用途:
本试剂盒用于体外定性检测人粪便样本中的KRAS基因突变
(包括但不区分 G12D、G12A、G12V、G12S、G12R、 G12C、G13D)、BMP3 和 NDRG4 基因甲基化及血红蛋白,各个指标的检测值通过“KRAS 基因突变及 BMP3/NDRG4 基因甲基化和便隐血联合检测分析软件”计算综合评分,用于对肠镜依从性差的结直肠癌高风险人群的筛查。综合评分大于或等于阳性判断值的样本为阳性,表示受检者体内可能有结直肠癌和/或进展期腺瘤,需要进一步接受肠镜检查;反之,如果综合评分低于阳性判断值,表示受检者体内有结直肠癌和/或进展期腺瘤的可能性低,但并不能完全排除疾病风险。鉴于受试者为高风险人群,因此在必要时仍应建议进行肠镜检查。
该产品适用人群为年龄40-74岁的结直肠癌高风险人群(高风险人群判定参照中国结直肠肿瘤早诊筛查相关专家共识)。本产品不能替代肠镜,不能用于普通人群的肿瘤筛查,临床诊断过程中不应以本产品检测结果作为临床诊断的唯一依据。

来源:致众医疗器械资讯


