您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-06-17 09:59
一.金属的晶体结构
自然界中,一切物质都是由原子组成的。按照原子在物质内部的排列方式,可以把物质分为晶体和非晶体两大类。金属和合金属于晶体。
01晶体的特点
原子按一定几何形状有规则、有次序地排列的物质称为晶体。晶体的特点是:有规则的外形;有固定熔点;具有各向异性。
02晶体结构
(1) 晶格
为了便于分析各种晶体中原子排列的规律可以用假想线将各原子的中心连接起来,这样就构成了空间格子。这种用来描述晶体原子排列形成的空间格子叫做“晶格”。晶格中线与线的交点就是原子所在的正常位置。可以把每两个原子中心的连线想像成原子之间的结合力,只要原子处于晶格中的正常位置,它所受到的每一对力都正好相互抵消。
(2) 晶面和晶向
晶格是由一层层的原子堆砌而成,晶格中各种方位的原子层叫“晶面”。晶格中由原子组成的任一条直线,它代表原子在晶体中的排列方向,这些直线就叫做“晶向”。
(3) 晶胞
用晶格来描述晶体结构很不方便,为了方便起见,通常取晶格中的一个最基本的单元,称之为“晶胞”。
二.金属晶体中最常见的晶格类型
01体心立方晶格
体心立方晶格的晶胞是一个立方体, 在立方体的每一个角上和立方体的中心都有一个原子。如α-铁、铬、钨、钒、钼等金属均具有这种晶格形式。
02面心立方晶格
面心立方晶格晶胞是一个立方体,在立方体的每一个角上(共8个角) 和每一个面上(6个面) 的中心都有一个原子。具有这种晶格形式的金属有γ-铁、铝、铜、镍等。
03密排六方晶格
密排六方晶格晶胞是一个六方柱体。在六方柱体的每一个角上和上下底面的中心各排列一个原子,在柱体中心还排列有三个原子。具有这种晶格形式的金属有镁、锌、钛等。
三.实际金属的晶格结构
以上所讲的晶体结构是理想状态下的晶体结构,实际上金属的晶体结构与理想的晶体结构相差很大。
01单晶体与多晶体
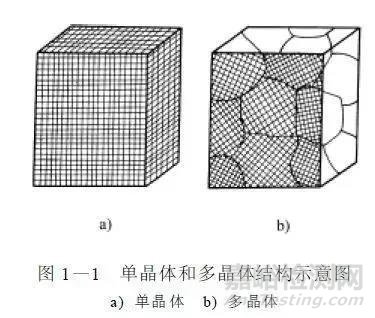
晶体分为单晶体和多晶体。晶胞都按相同方向排列的晶体称为单晶体。例如, 单晶硅( 制造半导体元件的材料)。由许多结晶方位不同的小晶体集合而成的晶体称为多晶体,如图1-1所示。大多数金属材料都是多晶体结构。
02晶粒与晶界
金属结晶后形成外形大小不规则而内部晶格排列方向一致的每一个微小晶体称为晶粒。多晶体就是由许多大小不一、外形不规则的晶粒所组成。晶粒与晶粒之间的交界面称为晶界。
03实际金属的晶体缺陷
实际晶体结构是不完整的,这对金属材料的性能有显著的影响。实际晶体缺陷有三类。
(1) 空位和间隙原子
由于原子热振动的影响,在晶体中原子可能离开原来占有的位置而造成“空位”。而离开了原来位置的原子( 或外来杂质原子) 跑到晶格间隙中便形成了“间隙原子”,如图1-2所示。
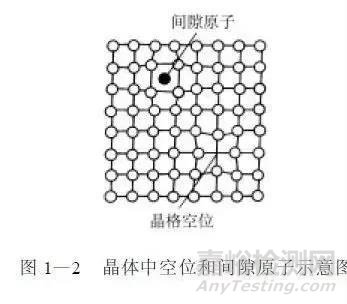
空位和间隙原子的运动,是金属晶体中原子扩散运动的主要方式之一。它直接影响着金属的某些性能和在金属中发生的某些物理化学过程。例如,化学热处理过程的进行,就是依赖于原子的这一扩散运动。
(2) 位错
它是一种线性的晶体不完整性。实际上就是晶体中某处有一列或若干列原子发生了有规律的错排现象。这种错排的类型很多,其中最简单的一种形式为刃型位错,如图1-3所示。
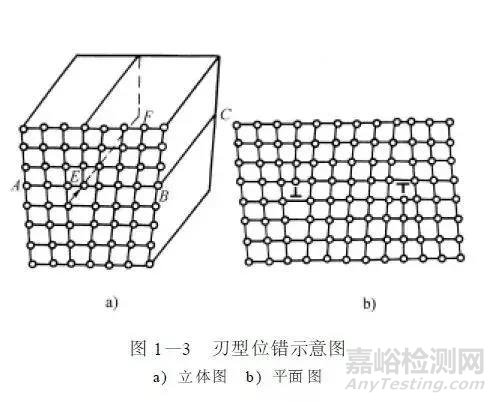
刃型位错是沿着某一个晶面插入了一个原子平面但没有插到底而形成的位错。实际金属晶体中存在大量的位错,一般在一平方厘米面积上含有10^8个位错。经冷加工变形后位错数目可达到每平方厘米10^12个。由于位错密度增加,因而使金属强度大大提高了。
(3) 晶界与亚结构
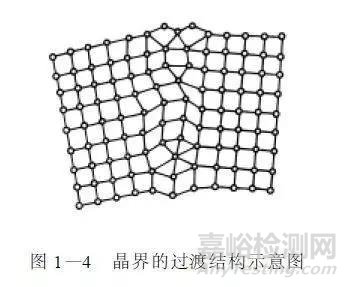
多晶体金属中,晶界处原子排列不规则,并常有杂质存在,这是金属材料中存在的一种很普遍的缺陷,它会使金属晶格产生畸变,图1-4 所示为晶界的过渡结构示意图。所以晶界处无论化学成分、结构和性能都与晶体内部有所差别。如抗蚀性晶界比晶粒内部差;细晶粒金属( 由于晶界面积大) 的硬度、强度比粗晶粒金属的高。
在实际金属晶体的每一个晶粒内部,都是由许多位向差很小的小晶块相互镶嵌而成,这些小晶块叫亚晶,如图1-5所示。亚晶与亚晶之间的分界称为亚晶界, 它的作用与晶界相似,对金属的性能起着重要影响。亚结构的细化,可使金属强度提高。

四.纯铁的性能与同素异构转变
01纯铁的性能
(1) 杂质:不超过0.01%。
(2) 熔点:1538℃。
(3) 力学性能:硬度HB80。
02同素异构转变
(1) 同素异构转变
金属在固态下随温度的改变,由一种晶格转变为另一种晶格的现象称为金属的同素异构转变。具有同素异构转变的金属只有铁、锰、锡、钛等少数金属,而多数金属结晶以后的晶体结构不再发生变化。
(2) 铁的同素异构转变
纯铁的冷却曲线如图1-6所示。
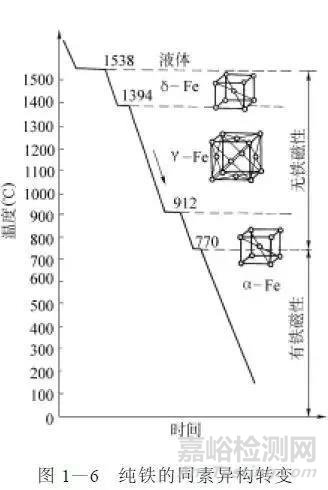
由图可知液态纯铁在1538℃时进行结晶,得到具有体心立方晶格的δ-Fe,继续冷却到1394℃时,发生同素异构转变,转变为具有面心立方晶格的γ-Fe, 继续冷却到912℃时,又发生同素异构转变,转变为具有体心立方晶格的α-Fe。如果再继续冷却,晶格类型不再发生转变。纯铁的同素异构转变可用下式表示:
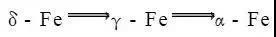
(3) 铁的同素异构转变特点
铁的同素异构转变是铁原子由一种晶格形式向另一种晶格形式的过渡。这种过渡必然伴随着原子排列形式的重新组合,而这种组合实际上是一种结晶过程。不过它不是从液态向固态的转变,而是由一种固态晶格向另一种固态晶格形式的转变。这种结晶过程与液态金属的结晶过程有相似之处,即有一定的转变温度,同样遵循晶核的形成和长大的结晶规律,伴有放热或吸热现象。
由于同素异构转变是在固态下发生的,与液态金属结晶相比又具有不同之处。例如,γ-Fe (面心立方) 原子排列密度较大而体积较小,冷却到912℃时,转变为原子排列密度小而体积大的α-Fe (体心立方) 会产生体积的变化。尽管这种体积变化的其绝对值不大,但当转变温度较低时会产生很大的内应力。这就是零件在热处理过程中产生变形、开裂的重要原因之一。
金属的同素异构转变具有很重要的意义。正是由于铁具有这一特性,生产中才能对钢和铸铁进行热处理以改变其内部组织,改善其性能。
五.合金的相结构
01关于合金的概念
(1) 合金
合金是指由两种或两种以上的元素( 主要是金属元素) 熔合在一起组成的具有金属特性的物质。例如,钢、铸铁、黄铜、硬铝等都是合金。合金除具有纯金属的基本特性外,还具有纯金属不具有的一些力学性能和物理化学性能指标。
(2) 组元
组成合金最基本的、独立的物质称为组元。组元一般是指组成合金的纯元素,或是稳定的化合物,如铁碳合金中的Fe3C。
(3) 合金系
由若干个给定组元可以配制成一系列成分不同的合金称为合金系。例如,Fe-C合金系。根据组元数目的多少可称为二元合金系、三元合金系。
(4) 相
在合金系中,具有相同的物理、化学性能并与该系统的其他部分以界面分开的这部分称为相。例如,液态合金是一个相,而在结晶过程中固体和液体并存,即为两相。合金的性能主要是由组成合金的各个相的结构、性能、形态、分布和各相的相对量所决定的。要了解合金的性能, 必须先了解合金的基本相结构。
02合金的基本结构
由两种以上元素组成合金时,在固态下合金的基本组织结构分为三类:固溶体、化合物、机械混合物。
(1) 固溶体
1) 定义
所谓固溶体是指溶质原子溶入溶剂的晶格中而仍保持溶剂晶格类型的一种合金晶体。根据溶质原子在溶剂晶格中所处位置不同,固溶体又分为间隙固溶体和置换固溶体。
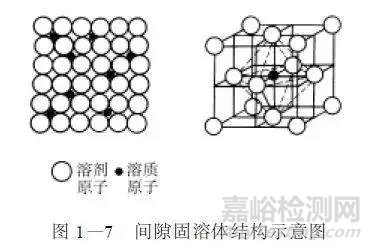
①间隙固溶体溶质原子分布在溶剂晶格间隙位置而形成的固溶体叫间隙固溶体,其结构示意图如图1-7所示。铁能与碳、氮、硼等非金属元素形成间隙固溶体。组成间隙固溶体的溶质组元都是一原子半径很小的非金属元素,而溶剂组元多为过渡族金属元素。
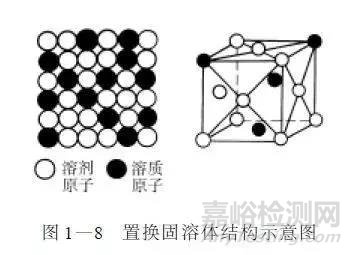
②置换固溶体溶质原子在晶格中占据了部分溶剂原子结点的位置而形成的固溶体叫置换固溶体,如图1-8所示。如硅、锰、铬、镍、钨、钼等能溶于铁中形成置换固溶体。
根据溶质在溶剂中的溶解情况,置换固溶体可分为无限固溶体和有限固溶体。若两组元能以任意比例相互溶解即称之为无限固溶体。反之,当溶质原子只能以一定比例溶解于溶剂中时, 即称之为有限固溶体。由于溶剂晶格的间隙是有限的, 所以间隙固溶体只能是有限固溶体。
2) 固溶强化
形成固溶体后,由于在溶剂晶格中溶入了溶质元素,必然会使溶剂晶格发生畸变,图1-9所示为形成固溶体时的晶格畸变。
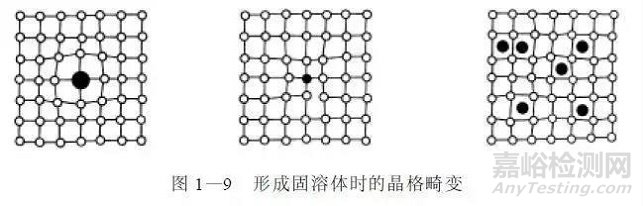
晶格畸变对金属性能会产生很大影响,是提高金属材料力学性能的重要途径之一。这种通过溶入溶质原子形成固溶体,使金属材料的强度、硬度提高的现象称为固溶强化。例如,适当控制固溶体中溶质的含量,可以使固溶体不但具有比纯金属高的强度和硬度,同时仍具有良好的塑性和韧性。固溶体还具有比纯金属更高的电阻率、更小的电阻温度系数和线胀系数。实际使用的金属材料,大多数是以固溶体作为合金中的基本相。
(2) 化合物
由多种元素按一定原子比数结合的物质称为金属化合物,它的结构不同于组成元素的结构。金属化合物有一定的化学成分( 一般可用分子式来表示其组成) ,并具有与组成它的任一组元素完全不同的复杂晶格,而且组元原子在晶格中占据有固定的位置。
金属化合物一般比纯金属熔点高,硬而脆,塑性、韧性差。当合金中存在有金属化合物时,根据金属化合物本身的结构、性能及其在合金中的相对量、形状、大小和分布特点,将对合金的性能产生不同的影响。
(3) 机械混合物
由两种以上的固溶体或由固溶体和化合物不按一定比数混合而构成的组织称为机械混合物。
在机械混合物中各个相仍保持各自的晶格和性能。机械混合物的性能取决于各组成相的性能及各相的数量、形状、大小及分布状况。机械混合物构成的合金比单相固溶体具有更高的强度和硬度,而塑性、韧性及抗腐蚀能力比单相固溶体低。

来源:Internet


