您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-07-14 22:14
关于《角膜曲率测量仪技术审查指南》公开征求意见的通知
各有关单位:
我局认证审评中心组织编制了《角膜曲率测量仪技术审查指南》(附件1),现已形成征求意见稿,即日起在网上公开征求意见。如有意见和建议,请填写反馈意见表(附件2),并于2021年8月1日前反馈至联系人。
附件:
1.《角膜曲率测量仪技术审查指南》
2.意见反馈表及联系方式
上海市医疗器械化妆品审评核查中心
2021年7月1日
角膜曲率测量仪注册技术审查指南
本指南旨在指导注册申请人对角膜曲率测量仪产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指南是对角膜曲率测量仪的一般要求,申请人应依据产品的具体特性确定相关内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指南是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指南。
本指南是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指南相关内容也将适时进行调整。
一、适用范围
本指南适用于《医疗器械分类目录》(原国家食品药品监督管理总局公告2017年第104号)中分类编码为16-03-02的角膜曲率计,按第二类医疗器械管理。同时,其他器械带有角膜曲率测量功能的部分可参照本指南执行,如16-03-01验光设备和器具、16-04-14眼前节测量诊断系统、16-04-12角膜地形图仪等。
二、技术审查要点
(一)产品的技术资料
1.预期用途
角膜曲率测量仪用于测量角膜前表面曲率半径和主子午线轴位。
2.产品名称
角膜曲率测量仪或具有角膜测量功能的产品名称应符合《医疗器械通用名称命名规则》(原国家食品药品监督管理总局令第19号)等相关法规的要求,可采用《医疗器械分类目录》或国家标准、行业标准上的通用名称。
3.工作原理
角膜曲率测量仪工作原理通常有三种。原理2和原理3不具备测量子午线轴位的功能,针对原理2和原理3的产品,本指南仅供参考:
1) 在角膜前一特定位置放置一特定大小的物体,该物经角膜反射后成像,测量出此像的大小,便可算出角膜的曲率半径,工作原理图如下(仅供参考):
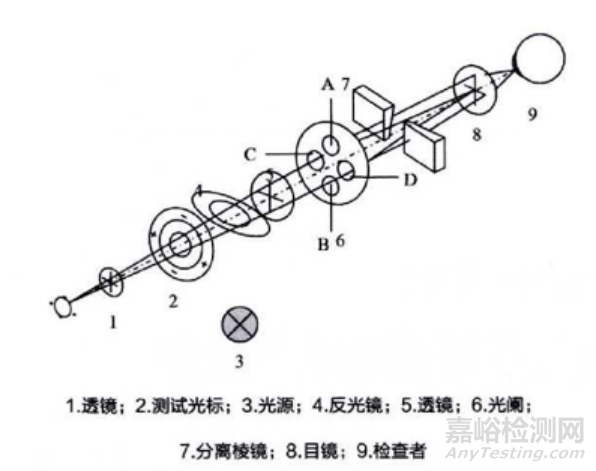
图1:角膜曲率测量工作原理图1
2) 通过采集角膜各角度方向截面高度数据并合成完整三维点云,进而计算角膜曲率数据(如Scheimpflug眼前节分析系统,OCT眼前节分析系统),工作原理图如下(仅供参考):
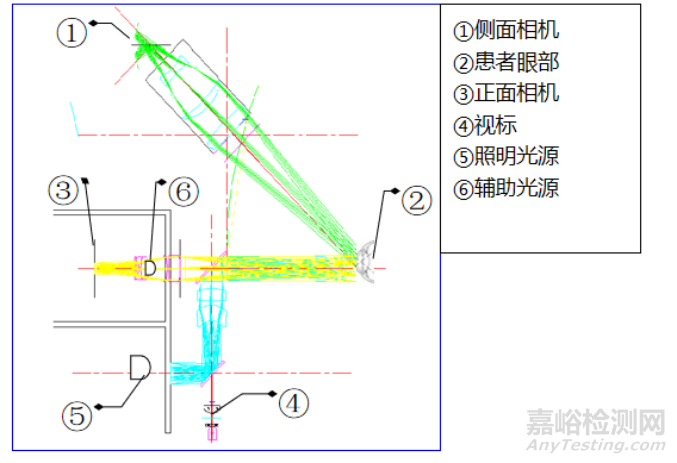
图2:角膜曲率测量工作原理图2
3) 基于投射的结构光源(如Placido盘、Led同心环等),经角膜表面反射后再通过透镜系统成像。通过分析图像上同心环的形变程度,可以求得不同位置的角膜曲率,工作原理图如下(仅供参考):
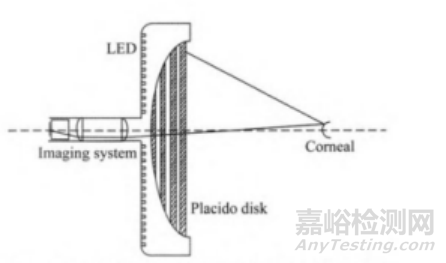
图3:角膜曲率测量工作原理图3
4.结构组成
角膜曲率测量仪通常由主机、底座、头托和软件组成。带角膜曲率测量功能的设备,该功能通常以模块(硬件和软件)方式体现。
产品示意图:
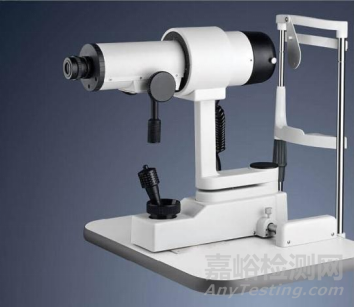
图4. 角膜曲率计示意图
5.注册单元划分的原则
注册单元划分应当符合《医疗器械注册单元划分指南》(2017年第187号通告)的要求,原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。一般情况下,手持式与台式若主要技术结构不同,应当划分为不同的注册单元;测量原理不同的,应划分为不同的注册单元(如:手动角膜曲率计与其他角膜曲率计应当划分不同注册单元)。
增加了升降台的台式产品为落地式,落地式与台式可以作为同一注册单元。
6.产品适用的相关标准
根据产品自身特点,适用以下相关标准:
表1. 相关标准
|
标准编号 |
标准名称 |
|
GB/T 191—2008 |
包装储运图示标志 |
|
GB 9706.1—2007 |
医用电气设备 第1部分:安全通用要求 |
|
GB 9706.15—2008 |
医用电气设备 第1-1部分:安全通用要求 并列标准:医用电气系统安全要求 |
|
GB/T 14710—2009 |
医用电器环境要求及试验方法 |
|
GB/T 16886.1—2011 |
医疗器械生物学评价 第1部分:风险管理过程中的评价与试验 |
|
GB/T 16886.5—2017 |
医疗器械生物学评价 第5部分:体外细胞毒性试验 |
|
GB/T 16886.10—2017 |
医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验 |
|
GB/T 25000.1-2010 |
软件工程 软件产品质量要求与评价(SQuaRE) SQuaRE指南 |
|
YY/T 0316—2016 |
医疗器械 风险管理对医疗器械的应用 |
|
YY 0579-2016 |
角膜曲率计 |
|
YY 0505—2012 |
医用电气设备 第1—2部分:安全通用要求 并列标准:电磁兼容 要求和试验 |
|
YY/T 0664-2008 |
医疗器械软件 软件生存周期过程 |
|
YY/T 0708—2009 |
医用电气设备 第1-4部分:安全通用要求 并列标准:可编程医用电气系统 |
|
ISO 15004-1:2006 |
眼科仪器 基本要求和试验方法第1部分:眼科仪器的通用要求 |
|
ISO 15004—2:2007 |
眼科仪器 基本要求和试验方法 第2部分:光危害防护 |
|
JJF 1774-2019 |
角膜曲率计型式评价大纲 |
|
JJG 1011-2018 |
角膜曲率计检定规程 |
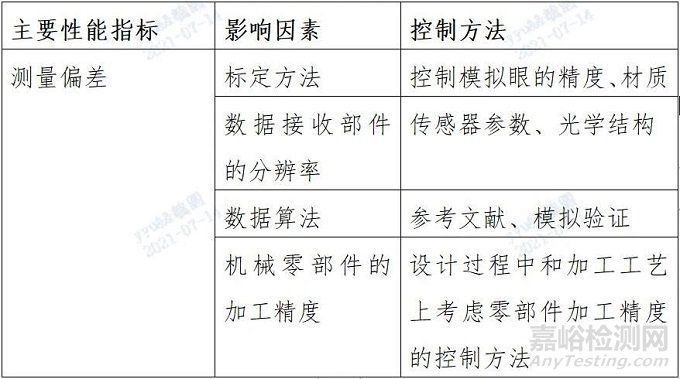
表3. 软件功能列表
|
一级功能 |
二级功能 |
功能描述 |
|
设置 |
语言设置 |
切换语言 |
|
日期格式设置 |
切换日期格式 |
|
|
服务器设置 |
设置服务器的IP地址、设置服务器端口号、设置http或https传输 |
|
|
软件信息 |
显示软件名称,版本,版权信息 |
|
|
病人信息管理 |
新增病人 |
输入病人姓名、ID、性别、生日、地址、电话、邮箱 |
|
查看病人 |
在病人列表中选择需要打开的病人 |
|
|
条件查询 |
||
|
编辑病人信息 |
编辑病人姓名、ID、性别、生日、地址、电话、邮箱 |
|
|
病历管理 |
新建病历 |
新建病历 |
|
删除病历 |
删除病历 |
|
|
查看病历 |
在病历列表中选择需要打开的病历 |
|
|
采集 |
影像资料采集 |
图片采集 |
|
预览缩放 |
||
|
左右眼显示 |
||
|
报告 |
显示角膜曲率测量结果 |
|
|
显示轴位测量结果 |
|
危害 |
可预见的事件序列 |
危害处境 |
损害 |
|
电磁能 |
|||
|
泄漏电流 |
产品漏电流超标 |
外壳、可触及金属与带电部分隔离/保护不够 |
漏电流超出允许值,导致人体感觉不舒服 |
|
电磁影响(EMC) |
在强电磁辐射源边使用验光仪测量 |
电磁干扰程序运行/抗干扰电磁配置不当或无配置 |
测量错误、测量结果误差过大 |
|
静电放电 |
干扰程序运行/接地不良或无接地 |
导致测量结果误差过大、或数据擦除 |
|
|
辐射能 |
|||
|
光辐射 |
产品光辐射超标 |
使用过程中光源发出辐射值超标的光 |
患者眼部收到照射,产生不适 |
|
热能 |
|||
|
高温 |
电池漏液 电子元器件发热 |
使用环境过热/电流过大 |
产品损坏 |
|
机械能 |
|||
|
不稳定断裂 |
患者支架刚度不够,承重超标 |
承重部分断裂 |
患者受伤 |
|
设备坠落 |
设备摔落、践踏后使验光仪破损 |
造成验光仪外壳出现锋棱 |
被验光仪划伤 |
|
振动 |
设备振动导致测量光路受损 |
设备没有进入测量状态 |
导致不能正确测量 |
|
坠落 |
坠落导致机械部件松动 |
产品破损 |
导致测量错误、误差过大或显示异常等 |
|
移动和定位患者 |
移动件使用磨损 |
定位不准确 |
影响患者测量 |
|
材料特征 |
|||
|
锐边和锐尖 |
产品外壳带有锐变和锐尖 |
患者触碰 |
划伤 |
|
可燃性 |
材料阻燃性差 |
设备过热燃烧 |
火灾 人员烫伤、烧伤 |
|
化学危害 |
|||
|
生物相容性 |
与患者接触部分生物相容性差 |
检查时材料与患者接触 |
患者皮肤不适、过敏 |
|
环境危害 |
|||
|
不当处置 |
设备采用非环保材料 |
寿命期后随意处置 |
环境污染 |
|
功能性危害 |
|||
|
患者数据采集、评估和显示 |
测量时被测者活动,说话 |
验光仪测量时被测人配合不当 |
测量时被测者活动,说话 |
|
数据传输 |
数据网络传输 |
协议不匹配 |
传输错误 |
|
功能丢失或降低 |
产品使用过程中 |
软件BUG卡死、或错误 |
设备无法使用或影响患者测量 |
|
数据和图像处理 |
数据计算处理 |
计算公式有误、精度不够 |
影响患者诊断 误诊 |
|
用户界面 |
软件操作界面 |
界面杂乱不便操作 |
影响操作流程 |
|
数据丢失 |
设备存储测量数据 |
软件BUG、设备故障 |
数据丢失 |
|
使用危害 |
|||
|
可预见的误用 |
产品使用过程中
|
可预见的误用 |
影响患者测量 |
|
使用错误 |
操作者分心操作失误 |
||
|
未经培训的用户 |
操作位未经培训不会操作设备 |
||
|
不适合的配件 |
设备零部件损坏 |
更换了不适合培训 |
设备无法正常工作 |
|
不适当的维护/质保 |
未规定保养方法 |
设备日常维护保养 |
设备损坏 |
|
工作流程和配置 |
未规定正确的操作流程 |
操作错误 |
影响患者测量 |
|
设备软硬件配置不达标 |
设备数据计算过程 |
设备卡死、数据丢失 |
|
|
标签和说明书相关危害 |
|||
|
不当标识 |
设备危险部件未正确标识 |
不当的触碰 |
患者受伤 |
|
不充分的用户信息 |
患者数据存储 |
存储的信息不充分 |
患者信息重复、无法查询等 |
|
不充分的安装、维修和维护规范 |
设备维护保养方法不充分 |
设备日常维护保养 |
影响设备测量精度 |
来源:上海市药品监督管理局


