您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-13 10:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
抗凝单抗获批国际Ⅲ期临床。PhaseBio公司和SFJ公司联合开发的新型单抗PB2452注射液(bentracimab)获国家药监局临床试验默示许可。这是一项国际多中心Ⅲ期临床REVERSE-IT试验,旨在研究在出现不受控制的大量或威胁生命出血,或需要紧急手术或侵入性手术的患者中,使用bentracimab对替格瑞洛抗血小板作用的逆转。该试验用于支持bentracimab在大出血和紧急手术适应症方面的生物制品许可申请(BLA)。
国内药讯
1.国药新冠疫苗在秘鲁的真研积极。秘鲁卫生部发布国药中生新冠灭活疫苗用于秘鲁医生接种的真实世界研究结果。在完成两剂次接种的57046医生中,该疫苗降低了98%的死亡率。另一项已完成2针接种的6104名医护人员的研究数据显示,仅有5.2%的接种者感染了新冠病毒。秘鲁国家卫生研究院(INS)认为,两剂国药疫苗可使至少96%的接种者体内产生针对新冠病毒的抗体。
2.GM-CSF中和抗体治疗新冠重症积极。天境生物GM-CSF中和抗体plonmarlimab治疗重症COVID-19伴发的细胞因子释放综合征的Ⅱ/Ⅲ期研究中期结果积极。与对照组相比,该新药治疗30天后患者死亡率更低(4.9%vs13.3%)、康复率更高(80.3%vs70.0%);而且其疗效与同款抗体药物lenzilumab在相似患者人群中的临床结果相当。
3.特瑞普利单抗获FDA突破性疗法认定。君实生物PD-1单抗特瑞普利单抗(商品名:拓益)获FDA突破性疗法认定,联合吉西他滨/顺铂一线治疗晚期复发或转移性鼻咽癌患者。去年9月,特瑞普利单抗单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗已获FDA突破性疗法认定。预计该公司将在今年第三季度内完成拓益联合化疗一线治疗复发或转移性鼻咽癌的BLA提交。
4.百济神州替雷利珠单抗获批新临床。百济神州PD-1单抗替雷利珠单抗注射液(商品名:百泽安)新适应症的临床试验申请获国家药监局批准,即将开展用于治疗HER2阳性不可切除的局部晚期或转移性胃食管腺癌的临床研究。百泽安是百济神州的重点产品,在中国已获批5项适应症。根据百济神州半年报,百泽安中国销售收入7490万美,同比增长148%。
5.迈威生物Nectin-4-ADC国内报IND。迈威生物Nectin-4靶向抗体偶联药物(ADC)9MW2821的临床试验申请获NMPA受理。Nectin-4是在多种实体瘤表面表达的细胞粘附分子,尤其在尿路上皮癌中高度表达。临床前研究显示,该品种在多种动物肿瘤模型中均具有良好的抑瘤效果,在食蟹猴、小鼠体内的安全性显示具有更好的治疗窗口。9MW2821也是中国境内公司同靶点药物首个进入IND的品种。
国际药讯
1.Moderna新冠增强疫苗临床结果积极。Moderna公司在一项Ⅱ期临床中检验接种第三剂mRNA-1273增强疫苗的效果。试验结果显示,两针完全接种6个月后,针对野生型新冠病毒的中和抗体水平仍维持在较高水平,但针对Beta、Gamma和Delta突变株的中和抗体水平显著降低;在接种第三剂mRNA-1273增强疫苗后,针对多种新冠突变株的中和抗体水平显著提高,其中针对Beta的几何平均滴度(GMT)提高32倍,针对Gamma的GMT提高43.6倍,针对Delta的GMT提高42.3倍。
2.Keytruda/Lenvima组合获批新适应症。FDA批准默沙东PD-1疗法Keytruda与卫材口服多受体酪氨酸激酶抑制剂Lenvima联合用药方案,用于一线治疗晚期肾细胞癌成人患者。在一项Ⅲ期临床CLEAR(研究307)/KEYNOTE-581中,与活性对照组相比,这一组合使疾病进展或死亡风险降低61%(HR=0.39,95% CI:0.32-0.49;p<0.0001),两个治疗组中位PFS分别为23.9个月和9.2个月;并使死亡风险降低34%(HR=0.66,95%CI:0.49-0.88;p=0.0049)。
3.默沙东Keytruda新适应症在美报sBLA。FDA受理默沙东PD-1疗法Keytruda单药用于治疗不可切除或转移性MSI-H/dMMR晚期子宫内膜癌患者的补充生物制品许可申请(sBLA),PDUFA日期为2022年3月28日。此项sBLA是基于一项正在进行的国际II期KEYNOTE-158研究中队列D和队列K结果。数据将首次在9月份举行的2021 ESMO大会上公布。
4.WHO推进治疗新冠药物临床试验。WHO开展的全球性临床试验Solidarity即将进入Solidarity PLUS试验阶段。该项试验将在52个国家/地区的COVID-19住院患者中测试三种获批药物:青蒿琥酯(artesunat)、伊马替尼(imatinib,格列卫)和英夫利昔单抗(infliximab)的效果,评估药物可能对死亡率产生的影响。这是全球600多家医院、数千名研究人员参与的WHO成员国之间最大规模的全球合作。
5.Vensica和Merz将在神经毒素领域合作。Vensica Therapeutics与Merz公司就Merz一款A型肉毒杆菌神经毒素Xeomin®签署战略合作协议。Xeomin是一种乙酰胆碱释放抑制剂和神经肌肉阻断剂。根据协议,Vensica获得在泌尿外科手术中无针使用Xeomin的授权。Vensica的无针药物输送平台将Xeomin输送到膀胱,以治疗膀胱过度活动症、神经源性膀胱和间质性膀胱炎等适应症。该协议旨在加快Vensica的临床试验和监管过程。在此合作中,Merz将获得Vensica的股权。
6.FDA拒绝批准罗沙司他上市。珐博进宣布收到FDA关于罗沙司他(roxadustat)用于治疗慢性肾性(CKD)贫血新药申请(NDA)的完整回复函。FDA要求该公司提交罗沙司他额外的临床研究。罗沙司他是一种口服firsit-in-class小分子低氧诱导因子脯氨酰羟化酶(HIF-PH)抑制剂,已在中国、日本、智利和韩国获批用于非透析依赖(NDD)和透析依赖(DD)成人慢性肾性贫血的治疗。对于罗沙司他,,FDA最初的PDUFA期限是2020年12月。
医药热点
1.全员核酸检测组织管理再加码。国务院应对新冠肺炎疫情联防联控机制医疗救治组发布《关于进一步加强全员核酸检测组织管理工作的通知》。《通知》强调,确定实施全员核酸检测后,要尽早尽快组织实施全员核酸检测实施方案,确保检测人数在500万以内的在2天内、检测人数大于500万的在3天内完成全员检测。
2.国家医保待遇清单制度出台。国家医保局、财政部日前印发《关于建立医疗保障待遇清单制度的意见》。医保待遇清单包含基本制度、基本政策,以及医保基金支付的项目和标准、不予支付的范围,根据党中央、国务院决策部署动态调整,适时发布。保障群众基本医疗需求的制度安排,包括基本医疗保险、补充医疗保险和医疗救助。各地在基本制度框架之外不得新设制度,地方现有的其他形式制度安排要逐步清理过渡到基本制度框架中。
3.云南省出台互联网医院执业管理办法。云南省卫健委日前发布《云南省互联网医院管理办法(试行)》,明确了云南省内互联网医院的设置审批、执业及监督管理等工作要求。《办法》明确,在互联网医院开展互联网诊疗活动的医师、护士应当能够在国家医师、护士电子注册系统中进行查询。医师应为具有3年以上独立临床工作经验的执业医师,并提供与其执业类别、执业范围相符的医疗服务。
审评动向
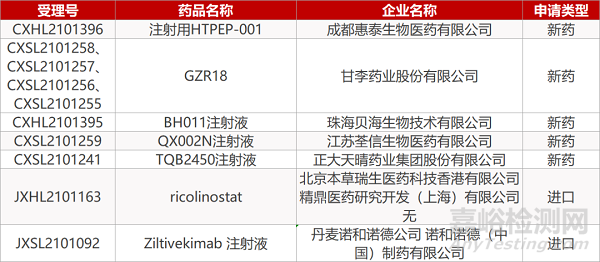
申请临床:
成都惠泰生物的注射用HTPEP-001、甘李药业的GZR18(4个规格)、珠海贝海生物的BH011注射液、江苏荃信的QX002N注射液、正大天晴TQB2450注射液、北京本草瑞生医药/精鼎医药的ricolinostat、诺和诺德的Ziltivekimab 注射液。
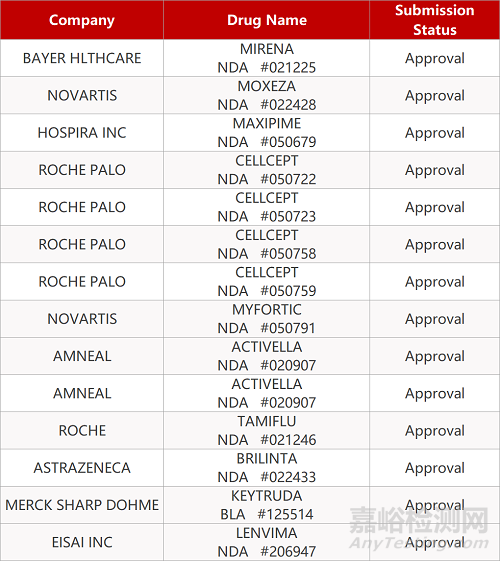
申请生产:

来源:药研发


