您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-20 10:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
诺华雷珠单抗两项眼疾适应症获批。诺华雷珠单抗注射液(诺适得)两项新适应症获国家药监局批准,用于治疗糖尿病视网膜病变(DR)和早产儿视网膜病变(ROP)。诺适得是一款抗血管内皮生长因子药物。自2011年在中国上市以来,诺适得已获批用于多项重要眼科疾病,包括湿性年龄相关性黄斑变性、糖尿病黄斑水肿、视网膜静脉阻塞和继发的黄斑水肿以及脉络膜新生血管。
国内药讯
国际药讯
1.恩格列净获FDA批准治疗心衰。FDA批准勃林格殷格翰和礼来联合开发的SGLT2抑制剂恩格列净(Jardiance)扩展适应症,用于治疗射血分数降低型心力衰竭(HFrEF)成人患者。在一项Ⅲ期临床EMPEROR-Reduced中,与安慰剂相比,Jardiance将患者的心血管死亡和因为心衰而住院构成的复合终点风险降低25%(HR=0.75,95% CI,0.65-0.86);将患者因为心衰而首次或再次住院的风险降低30%(HR=0.70, 95% CI,0.58-0.85)。在中国,恩格列净也递交了上述适应症的上市申请。
2.两种Opdivo方案在欧盟进入审查。欧洲药品管理局(EMA)受理百时美施贵宝PD-1疗法Opdivo(欧狄沃,nivolumab,纳武利尤单抗)的II类变更申请,Opdivo联合抗CTLA-4疗法Yervoy(ipilimumab)、Opdivo联合化疗(氟尿嘧啶+顺铂),一线治疗不可切除的晚期、复发或转移性食管鳞状细胞癌(ESCC)成人患者。在一项Ⅲ期CheckMate-648试验中,与化疗相比,Opdivo+化疗方案显著改善PD-L1≥1%患者群和总患者群体的总生存期(中位OS:15.4个月vs9.1个月;中位OS为13.2个月vs10.7个月);Opdivo+Yervoy方案也显著改善这两个患者群的总生存期(中位OS:13.7个月vs9.1个月;中位OS:12.8个月vs10.7个月)。
3.诺华VEGF单抗眼科Ⅲ期临床积极。诺华公布评估VEGF单抗Beovu(brolucizumab,6mg)与Eylea(阿柏西普,2mg)相比治疗糖尿病性黄斑水肿(DME)的2项Ⅲ期临床阳性结果。KITE试验第100周的结果显示,Beovu给药间隔12周或16周时,第二年结果与第一年一致,包括最佳矫正视力(BCVA)的维持、CSFT的更大减少以及使用Beovu和Eylea治疗存在IRF/SRF的眼数的减少。KINGFISHER试验第52周时,Beovu每四周给药一次的方案使患者BCVA从基线的变化达到非劣效标准;Beovu关键积液方面也显示出优于Eylea。
4.创新病毒免疫疗法启动头颈癌临床。Istari Oncology公司具有三重作用机制、CD155靶向的新型病毒免疫疗法将扩展Ⅰ/Ⅱ期临床试验LUMINOS-103,评估用于治疗头颈部鳞状细胞癌(HNSCC)的潜力。PVSRIPO是一款基于Sabin 1型脊髓灰质炎减毒活疫苗的在研免疫疗法。CD155在几乎所有的实体瘤上都有表达。此前,LUMINOS-103试验已评估PVSRIPO联合或不联合PD-1/L1抑制剂,治疗多种肿瘤类型的疗效。
5.Immunitas拟加速推进CD161抑制剂进入临床。Immunitas公司完成5800万美元的B轮融资,以推进其治疗实体瘤和血液癌症的新型自然杀伤(NK)细胞和T细胞调节剂IMT-009进入临床。IMT-009是一款CD161抑制剂。CD161是一种表达在NK细胞和T细胞表面的受体蛋白,它通过与表达在肿瘤表面的配体CLEC2D结合,抑制NK细胞和T细胞的激活。Immunitas计划明年上半年向FDA提交IMT-009的首个IND申请。
6.Orion公司携手Alligator开发双抗疗法。Alligator Bioscience与Orion公司签订合作和许可协议,将利用Alligator Bioscience专有的噬菌体展示文库和RUBY双特异性平台,根据Orion选择的免疫肿瘤学靶标,共同开发新型双抗疗法。根据协议,Alligator Bioscience将获得预付款和研究支持款项,以及可能高达4.69亿欧元的开发、获批和销售里程碑款项。该协议涵盖开发三种双特异性抗体的选择。
医药热点
1.建立医疗机构感染防控工作“四项机制”。为指导各地进一步加强医疗机构感染预防与控制工作,国务院日前印发通知,决定建立专业团队年度评估机制、卫生健康行政部门每月抽查检查机制、医疗机构一把手负责制和每月研究机制、追责问责机制“四项机制”。对因责任不落实、整改不到位而发生院内感染的,直接追究其一把手责任,并对有关责任人依法依规予以严厉惩处。
2.胰岛素集采方案拟征求意见。业内日前流出一份《国家组织胰岛素集中带量采购方案(征求意见稿)》。意见稿中指出,今年9月份将启动胰岛素集采相关工作,2022年初执行,采购周期为2年。采购范围和分组:二代和三代胰岛素均分别按速效、基础和预混分为 3个组,共6组。以企业+通用名为单元展开竞争,同组内各通用名产品公平竞争。
3.我国修改人口计生法。17日,人口与计划生育法修正草案提请十三届全国人大常委会第三十次会议审议。此次的修正草案重点围绕实施三孩生育政策、取消社会抚养费等制约措施、配套实施积极生育支持措施进行修改,同时强化对全面两孩政策实施前计划生育家庭权益的保障。这是自全面两孩政策实施修改人口计生法以来,对这部法律的又一次重大修改。
评审动态
申请临床:
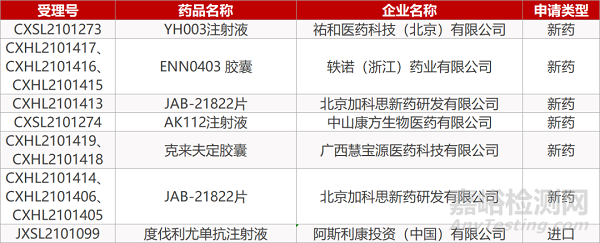
祐和医药的YH003注射液、轶诺(浙江)的ENN0403 胶囊(3个规格)、北京加科思的JAB-21822片(4个规格)、中山康方的AK112注射液、广西慧宝源的克来夫定胶囊(2个规格)、阿斯利康的度伐利尤单抗注射液。
申请生产:

来源:药研发


