您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-12-08 20:34
微生物相关需公告机构评审的范围及内容:
• 所有无菌医疗器械
• I类可重复使用的手术器械的再处理的说明书/操作方法
• 非无菌提供,但使用前需要灭菌的产品
如何满足MDR中与微生物/无菌有关的法规要求?
相比MDD 附录I基本要求(ERs),MDR 附录I通用安全和性能要求(GSPR)在感染和微生物污染方面的主要变化:
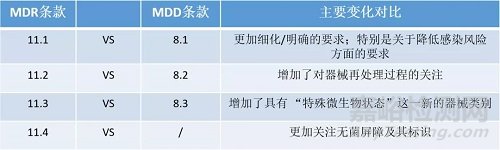
其他变化
MDD 8.2中关于传染性海绵状脑病的要求转到MDR GSPR 13(包含生物来源的器械)以及动物源组织指令(2003/32/EC)中进行覆盖。含有动物源组织的医疗器械必须同时符合动物源组织指令(2003/32/EEC)和医疗器械指令(93/42/EEC)才被允许在欧盟市场上销售。
无菌器械:指不含活的微生物的器械。
—— MDR未对无菌医疗器械的定义进一步说明
—— EN 556-1规定,器械必须达到10⁻⁶ 或以下(如10⁻⁷ 等)的无菌保证水平(SAL,器械上存在活的微生物的概率),才能认为最终灭菌的医疗器械是无菌器械。
医疗器械达到无菌的工艺有两种:终端灭菌和无菌生产工艺。
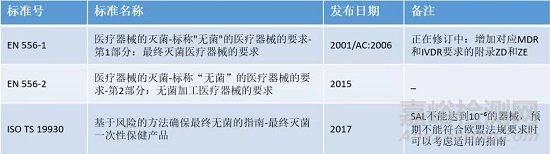
目前公认有效的终端灭菌方法有
环氧乙烷灭菌
EN ISO 11135
辐照灭菌
EN ISO 11137
湿热灭菌
ISO 17665-1
干热灭菌
EN ISO 20857
低温蒸汽和甲醛灭菌
EN ISO 25424
液体化学灭菌剂
EN ISO 14160
低温汽化过氧化氢
ISO NP 22441
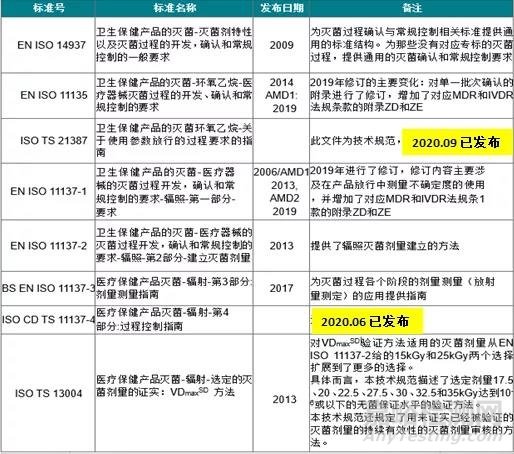
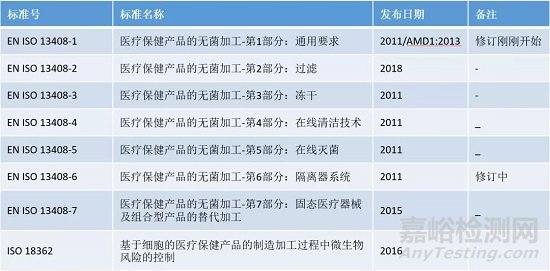
医疗器械的灭菌确认与常规控制的标准
目前根据不同的灭菌方式,存在一系列的标准用来确保灭菌过程的可靠性和可重现性,以证实最终灭菌的产品满足了EN 556-1所要求的无菌性能。所有这些与灭菌确认和常规控制相关的标准都使用共同的一组定义和行文格式,结构上通常包括:
- 灭菌剂特性
- 过程与设备特性
- 产品定义
- 过程定义
- 确认(包括IQ,OQ和PQ)
- 常规监视与控制
- 产品灭菌放行
- 过程有效性维护
其中EN ISO 14937一般是在所使用的灭菌方式还没有对应的确认与控制方面的标准时适用。
医疗器械的灭菌确认与常规控制的标准
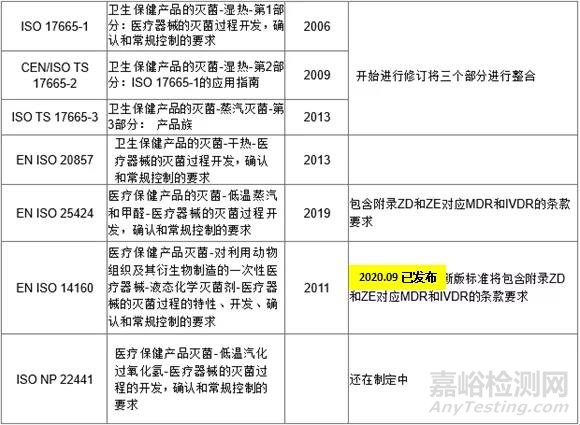
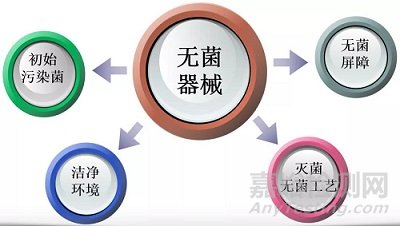
无菌生产工艺

来源:微珂器械服务


