您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2022-04-09 22:26
近年来,人工智能算法不断升级迭代,为医疗行业实现智能化转型提供了新的思路和手段,也为医疗器械产业发展带来了重大机遇,而人工智能医疗器械的审批标准也在不断细化。本期小编跟大家聊一聊,国内人工智能医疗器械产品注册证审批现状。
2019-2021年AI医疗器械行业发展现状
市场规模
国内AI医疗器械市场规模从2019年的1.25亿元大幅增长至2020年的2.92亿元,同比增长134%,预计2022年将继续大幅增长,达到11.56亿元。
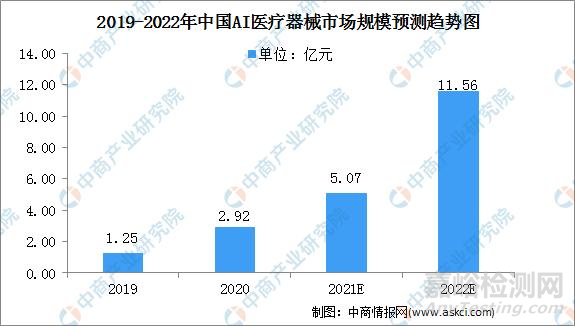
数据来源:Frost& Sullivan、中商产业研究院
AI医疗器械注册证审批现状分析
2021年AI医疗器械注册证审批情况
据国家药品监督管理局(NMPA)2021年度医疗器械注册工作报告显示,截至2021年12月31日,全国各地药品监管部门共办理境内第二类医疗器械注册31509项、境内第三类医疗器械注册4596项。其中NMPA批准的AI类医疗器械注册证书(二类证及三类证)一共153个。
部分AI医疗器械产品二类、三类证注册情况如图1、图2所示:
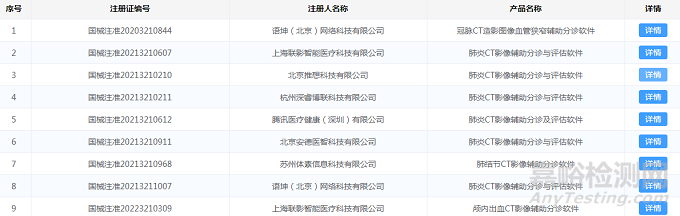
图1
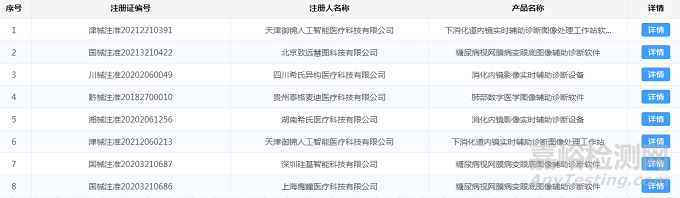
图2
国内AI医疗器械审批细则对比
2022年有关国内AI医疗器械产品的审评要求及部分描述与2019年《深度学习辅助决策医疗器械软件审评要点》(以下简称:《要点》)有较大的区别。这里卓睦菌给大家做一个对比:

资料来源:
《深度学习辅助决策医疗器械软件审评要点》
《人工智能医疗器械注册审查指导原则》
关键点解析:
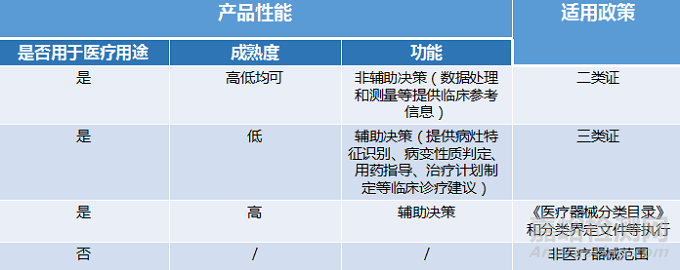
1、辅助决策/非辅助决策定位、用途细分
2019年的《要点》对AI医疗器械软件的辅助决策/非辅助决策定义作较简短的解释,2022年《人工智能医疗器械注册审查指导原则》(以下简称:《原则》)则给出较细致的补充说明。
辅助决策产品大体细分为辅助分诊、辅助检测、辅助诊断、辅助治疗4类。非辅助决策明确其定位仅提供医疗参考信息,如流程优化、诊疗驱动,不进行医疗决策。有助申报企业明确其AI医疗器械产品的具体定位及用途。
2、细化三类数据来源
对于人工智能医疗器械的数据来源,2019年《要点》的描述是“医疗器械所生成的医学图像、医学数据”。
2022《原则》详细写明三类数据来源,这些数据来源的共同点是用于医疗用途的客观数据。值得一提的是,在特殊情形下,患者使用手机拍摄自己的症状照片用作疾病辅助诊断,这类图像也属于医疗数据。
3、黑盒算法设计与医学知识建立关联
2019年《要点》中,算法设计建议数据驱动与知识驱动相结合。具体是哪些领域相关知识,《要点》并没有提及。而2022年《原则》里提到,对于黑盒算法,算法设计应开展算法性能影响因素分析,同时建议与现有医学知识建立关联,提升算法可解释性。
AI医疗器械二类/三类证审批对比
2018年8月,新版《医疗器械分类目录》正式生效,首次为AI医疗器械产品按二类、三类医疗器械设置审批通道。
结合2019年《要点》与2022年《原则》对第二类、第三类AI医疗器械产品的用途描述来看,成熟度低、用于实时性辅助决策的AI医疗器械产品更适合申报第三类注册证。
二类证和三类证都需要技术审评,但审批工作时长各有不同。二类证的技术审评要60个工作日内完成,三类证的技术审评则是90个工作日内完成。
AI医疗器械注册证(第二类、第三类)审评流程一览:
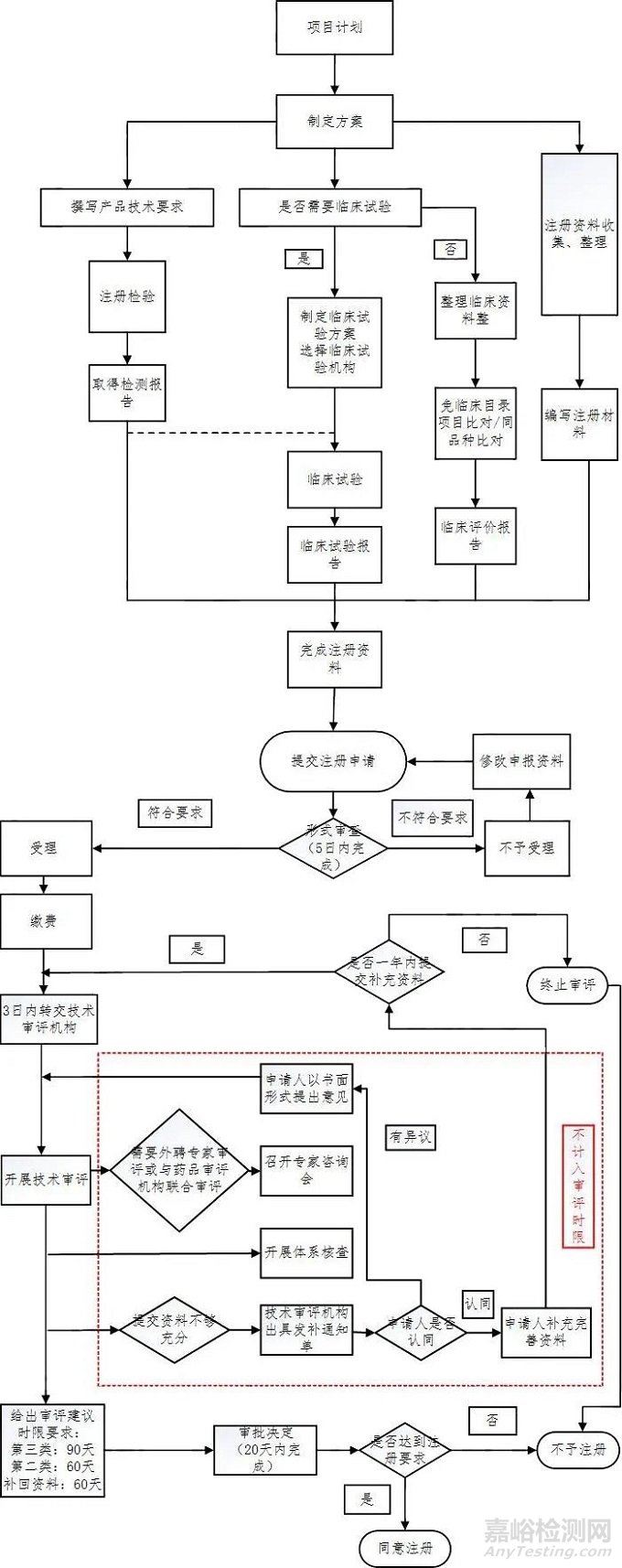
资料来源:网络
AI医疗器械商业模式
拿下注册证后,AI医疗器械产品如何实现商业落地?从产品形态、销售渠道、盈利模式、运营模式、客户关系的角度,结合来看AI医疗器械产品现有商业模式:

AI医疗器械产品的商业运营模式多以“B2B2H”、“B2H”,即研发商与当地渠道商、保险企业、第三方影像中心或体检机构合作推广,医院为最终付费对象。
合作推广路径参考下图:
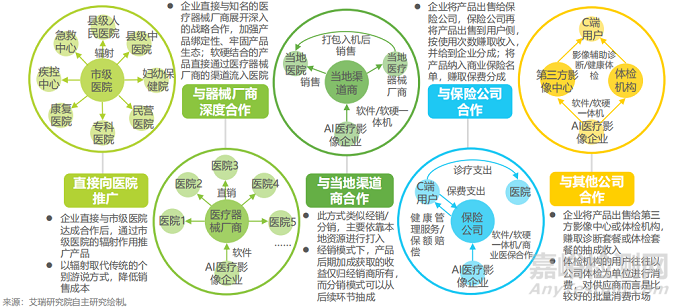
资料来源:艾瑞研究院
未来AI医疗器械审批趋势预测
国内AI医疗器械产品“先拿证后上市”这个大趋势仍不变。从注册证审批数量、产品定位及用途细分来看,二类证注册仍然占多数。无监督学习、联邦(联合)学习等机器学习算法纳入2022《原则》中,三类证的审批通过数量将有所提升。建议研发商根据具体盈利战略及产品定位、用途做对应申报。
实时性辅助决策类AI医疗器械产品由于使用风险程度较高、成熟度较低,一旦通过三类注册证审批,此类产品可获得更有力的临床背书,降低院内推广难度。
像电子病历、检验检查报告结论等这些文本类数据,有望成为人工智能医疗器械审批重要数据来源补充。

来源:医师周刊


