您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-08 10:51
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
艾欣达伟FIC抗肿瘤新药上I期临床。深圳艾欣达伟医药1类新药AST-001注射液在I期临床中完成首例受试者入组及给药。该项研究拟评估AST-001单药在晚期恶性实体肿瘤患者中的安全性和耐受性以及评估受试患者中AST-001及其代谢产物的药代动力学特征与初步疗效。AST-001是该公司通过AKR1C3酶活化平台自主开发的一款潜在“First-In-Class”小分子偶联药物,已在临床前研究中显示出广谱、显著的抗肿瘤作用和良好的安全性。
国内药讯
1.君实PD-1单抗出海美国再报BLA。FDA受理君实生物PD-1特瑞普利单抗重新提交的生物制品许可申请(BLA),联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌(NPC)患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。PDUFA日期为2022年12月23日。公布在AACR2022年会上的Ⅲ期临床JUPITER-02更新结果显示,特瑞普利单抗联合化疗使患者疾病进展或死亡风险降低48%。在美国,尚无免疫疗法获批用于治疗鼻咽癌。
2.吉利德HIV复方新适应症在华报产。吉利德科学5.1类新药恩曲他滨丙酚替诺福韦片(Ⅱ)的新适应症上市申请获CDE受理。恩曲他滨丙酚替诺福韦片(Ⅱ)是一款固定剂量复方制剂(200mg恩曲他滨/25mg丙酚替诺福韦),最早于2016年获FDA批准(英文商品名:Descovy)上市,与其它抗病毒药物联用治疗HIV感染患者。2019年10月,基于全球Ⅲ期注册临床试验DISCOVER积极结果,FDA批准Descovy用于HIV暴露前预防(PrEP)的新适应症。
3.神州细胞血友病新药儿科Ⅲ期临床积极。神州细胞开发的重组人凝血因子Ⅷ(商品名:安佳因)将在ISTH 2022年会上公布用于血友病A儿童患者预防治疗的Ⅲ期研究成果。24周治疗数据显示,全分析集中位年化出血率(ABR)仅2.21次,0出血患者达39.7%。0-5岁幼儿组ABR中位值为2.21,而6-11岁学龄组ABR中位值为2.17,这款新药在两组患者中展现出一致的疗效。2021年7月,安佳因已在中国获批上市,用于青少年及成人血友病A患者出血的控制和预防。
4.歌礼新冠口服药在美报IND。歌礼制药已向FDA递交COVID-19口服候选药物聚合酶(RdRp)抑制剂ASC10的新药临床试验(IND)申请。ASC10是抗病毒核苷类似物ASC10-A的口服双前药,歌礼拥有该新药完整全球开发及商业化权益。临床前研究显示,ASC10-A对包括奥密克戎在内的多种新冠病毒变异株有较强的体外抗病毒活性。全球范围内,已有5款针对新冠的dRp抑制剂获批上市。
5.诺诚健华BCL2抑制剂报IND。诺诚健华自主研发并拥有全球自主知识产权的1类新药ICP-248的临床试验申请获CDE受理。ICP-248是一种高选择性BCL2抑制剂,可激活caspase介导的凋亡级联反应,恢复和促进肿瘤细胞凋亡,发挥抗肿瘤作用。该新药拟开发用于治疗非霍奇金淋巴瘤(NHL)、急性淋巴细胞白血病 (ALL)等恶性血液系统肿瘤。目前全球范围内同靶点药物仅有艾伯维的维奈克拉获批上市。
6.百济神州入局mRNA疗法赛道。百济神州宣布与深信生物(InnoRNA)达成全球战略合作,将利用深信生物的LNP递送技术和mRNA药物研发平台,合作开发新型mRNA疗法。根据协议,深信生物将获得一笔首付款,药物开发、注册和商业化里程碑后期付款,以及产品分级特许权使用费。百济神州将拥有合作产品的全球独家开发和商业化权利。
国际药讯
1.安斯泰来更年期新药报NDA。安斯泰来宣布,已向FDA提交NK3R拮抗剂fezolinetant的新药上市申请,用于治疗与绝经相关的中重度的血管舒缩症状(VMS)。Fezolinement旨在通过阻断神经激肽B与Kisspeptin/神经激肽/强啡肽神经元的结合,调节大脑体温调节中枢(下丘脑)的神经元活动,以降低绝经相关中重度VMS的频率和严重程度。如果获批,fezolinant将成为这类患者的“first-in-class”的非激素治疗选择。
2.基因泰克双抗获FDA优先审评。FDA受理罗氏旗下基因泰克CD20/CD3 T细胞衔接双特异性抗体mosunetuzumab的生物制品许可申请,用于复发/难治型滤泡性淋巴瘤的治疗。FDA同时授予其优先审评资格,PDUFA日期为2022年12月29日。在关键Ⅰ/Ⅱ期临床GO29781中,中位随访为18.3个月时,患者的完全缓解率达到60%,客观缓解率为80%。今年4月,该疗法上述适应症已获欧盟人用药品委员会(CHMP)推荐有条件批准上市。
3.口服IL-10抑制剂治疗UC Ⅱ期结果出炉。Applied Molecular Transport公司公布肠胃道选择性IL-10抑制剂AMT-101与TNFα抗体adalimumab联合治疗中重度溃疡性结肠炎(UC)的Ⅱ期临床MARKET研究结果。8周治疗数据显示,联合治疗的临床缓解率为31.8%,而adalimumab单药组这一数值为33.3%,显示联合用药在临床上没有任何改善。但在亚组分析中,5年内确诊为UC的患者中,联合治疗组的临床缓解率达到43.8%(vs15.4%)。临床中,AMT-101总体耐受性良好。
4.Vertex重启糖尿病干细胞疗法早期临床。Vertex公司同种异体干细胞VX-880获FDA批准重启用于治疗1型糖尿病(T1D)的Ⅰ/Ⅱ期临床试验。今年6月公布在美国糖尿病协会科学会议上的最新数据显示,2例患者均实现葡萄糖响应性胰岛素生成,改善了血糖控制,同时减少了对外源性胰岛素的需求;而且VX-880的耐受性良好。VX-880旨在通过恢复胰岛细胞功能,来恢复机体调节血糖水平的能力。FDA已授予VX-880快速通道资格。
5.田边三菱布局创新基因靶向疗法。田边三菱制药与EditForce公司将利用后者专利三角状五肽重复(PPR)蛋白平台,针对中枢神经系统(CNS)领域内的特定靶标合作开发候选基因疗法。与传统的锌指蛋白、TALEN、以及CRISPR基因编辑技术不同,PPR蛋白技术能通过蛋白质来靶向RNA分子。根据协议,EditForce将获得预付款和药物开发、商业化里程碑后期付款,以及药物全球销售的专利权使用费,交易总金额达200亿日元(约1.46亿美元)。
医药热点
1.海南助产毕业生可先上岗。海南省教育厅、人社厅、财政厅、国资委、卫生健康委5部门近日印发《关于促进海南高校毕业生等青年就业创业工作的若干政策措施》,其中规定对受疫情影响而暂未取得护士执业资格证的2021届和2022届高校毕业生,实施“先上岗、再考证”阶段性措施。
2.二级公立医院救治能力不断提升。7月6日,国家卫健委办公厅发布《关于2020年度全国二级公立医院绩效考核国家监测分析情况的通报》。《通报》显示,2020年,住院患者中实施微创手术和三级手术的患者数量进一步增加,手术患者中实施微创手术和三级手术的患者比例均较2019年有所提高。参加考核的全国二级公立医院总体病例组合指数(CMI值)相当于2019年的1.06倍。二级公立医院救治能力和临床诊疗过程管理水平不断提升。
3.武汉大学人民医院医学与物理研究院揭牌成立。7月5日下午,武汉大学人民医院医学与物理研究院成立并揭牌。中国科学院院士、武汉大学物理科学与技术学院教授徐红星受聘担任武汉大学人民医院医学与物理研究院院长。武汉大学人民医院医学与物理研究院旨在贯彻落实国家创新驱动发展与健康中国战略部署,搭建医学与物理学科交叉创新研究与转化平台,集合跨学科人才与资源,以先进物理科学技术为先导,推动疾病早期诊断、精准治疗、系统康复以及慢病防控领域的医疗技术创新和先进医疗装备研制。
4.全球已报告超6000例猴痘病例。据法新社报道,世卫组织总干事谭德塞当地时间6日表示,目前全球已有58个国家和地区报告超过6000例猴痘确诊病例。据悉,85%的猴痘病例在欧洲,其次是非洲地区、美洲、东地中海和太平洋地区。世卫组织最晚将于7月18日重新召开猴痘紧急委员会会议。
评审动态
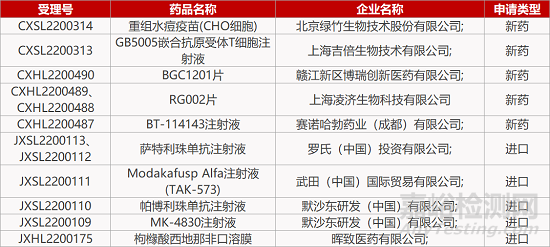
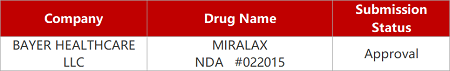

来源:药研发


