您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-21 21:51
等同性论证既是判断申报产品与选择的对比医疗器械是否等同的过程,对比产品若能通过论证证明其与申报产品基本等同,对比产品视为申报产品的等同产品,可进行同品种临床评价。
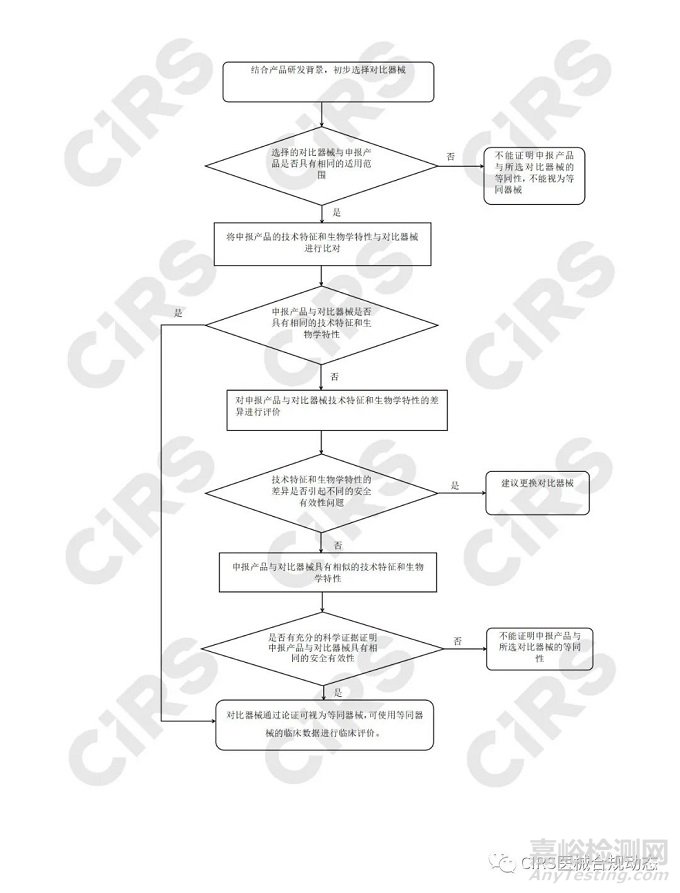
等同性评价主要包括三方面,适用范围等同性判定、技术特征等同性判定、生物学特性等同性判定,具体等同性判定流程见附录。
一、等同性判定过程
1、适用范围等同性判定
进行等同性论证的产品首先应具有相同的适用范围,基于相同的适用范围,进一步在技术特征和生物学特性方面进行比对,证明二者基本等同。因此首先要对产品的适用范围进行对比,这里的适用范围不仅局限于注册证载明的预期用途,还要考虑适应人群等信息。适用范围的对比项目包括以下11个方面(不适用的除外):
(1)适应证:包括器械预防、诊断、缓解、治疗或者监护的疾病或症状;
(2)适用人群:如年龄、性别、体重等对适用人群的限定;
(3)适用部位:如临床应用的具体人体部位、器官、组织、体液等;
(4)与人体接触方式和时间:如植入或体表接触、接触时间、接触次数等;
(5)疾病的严重程度和阶段:如疾病的名称、分型、分期、严重程度等;
(6)使用条件:如使用环境(家用、医院、具体科室、手术室、救护车等)、配合使用的器械或药品、使用者要求等;
(7)重复使用:如可否重复使用、可重复使用的次数和时间等;
(8)使用方法;
(9)禁忌证;
(10)警告及预防措施;
(11)其他。
通过比较申报产品与对比器械的适用范围及临床使用相关信息的,对二者差异进行识别、阐述和评价,判定适用范围是否相同。当适用范围差异导致两者风险有明显差异时,临床安全有效性具有显著差异,认为对比器械与申报产品的适用范围不同。
需要注意的是,适用范围的差异并不一定会导致适用范围的不同,例如申报产品与对比器械适应症有差异但属于同性质使用,可认为二者具有相同的适用范围。企业应对适应症差异性不导致预期用途差异提供充分的同质性阐述。
2、技术特征、生物学特性的对比
在确定申报产品与对比医疗器械具有相同的适用范围后,注册申请人需提供技术特征和生物学特性的充分信息并对其逐项对比。
(1)技术特征包括:
①设计信息:
-工作原理、作用机理;
-器械设计特征及依据:如组成、材料、产品结构的表征(可根据产品特征,选择适用的方式,包括结构图、三视图、爆炸图、局部细节放大图、工程图等)、尺寸和公差、软件等;
-申报器械的重大特性,明确其在整体设计和适用范围下的用途;如果没有明确的用途,应重点详述特定的设计或组件如何促进申报器械的整体使用和功能。
②材料:
-部分产品尤其是植入性医疗器械由于与人体组织直接接触,需明示组成材料详细、完整的化学组成,识别添加剂,如着色剂、涂层或其它表面改性剂等;
-部分产品的材料加工方式(如锻造或铸造)及其状态(如无定形或结晶)可能影响产品的安全有效性,适用时需考虑列出;
-除医疗器械常见组成材料外,部分产品可能涉及生物制剂、药物、涂层、添加剂等。
③能源:如对器械的能源传递(如电池的使用),作为器械功能方面的一部分且对使用产品的患者和/或医务人员有影响的能源传递(如X射线、激光、射频、超声)等。
④产品性能、功能及其他关键技术特征:
-从测试方式角度,如实验室测试、计算机模拟、动物试验、其他模拟临床使用的非临床研究等。
-从技术特征角度,如疲劳、磨损、抗拉强度、压迫、流量、爆裂压力、软件/硬件特性、软件核心算法、密度、孔隙度、体外降解特性、试验方法的原理等。
(2)生物学特性主要包括:
如降解性能、生物学反应(如免疫反应、组织整合等)等。
在论证等同性或分析差异时,注册人应提供相应的支持性资料作为安全有效性等同的有效科学证据,如技术要求、说明书、文献研究等,一般性描述通常不足以作为支持证据。支持性资料通常需包括准确、可靠、完整、可追溯的数据,必要时包括数据的产生过程,试验/实验数据建议来自有良好质量控制的实验室。
通过等同性论证的对比产品一般为如下两种情形:
申报产品与对比器械具有相同的适用范围、技术特征和生物学特性;
申报产品与对比器械具有相同的适用范围,相似的技术特征和生物学特性;有充分的科学证据证明申报产品与对比器械具有相同的安全有效性。
二、等同性判定中的问题
1、等同性论证时,由于产品功能、设计不同,存在需要与多个产品进行临床评价的情况,比如产品的功能模式涵盖了多个产品的功能,此时可根据功能模块或模式分别与不同的对比产品对比;但应选择与申报产品尽可能相似的产品作为对比器械。
2、当对比产品与申报产品有技术特性差异时,某一方面的差异是否引发不同的安全有效性问题,因具体产品和不同情形而异。产品与选定的对比产品在某一技术特性上有差,但已上市其他的产品(适用范围相同)中有与申报产品相同的技术特征,此时,注册人可以通过相关支持资料论证差异性不影响安全有效性,论证是否充分受差异大小和支持性资料的影响。
3、临床评价中等同器械的资料内容
表1对比器械的基本信息
|
对比项目 |
对比器械1 |
对比器械2(如有) |
|
产品名称 |
||
|
注册证号 |
||
|
结构组成 |
||
|
适用范围 |
||
|
生产企业 |
||
|
技术特征 |
表2申报产品与对比器械的对比表
|
对比项目 |
申报产品 |
对比器械 |
相同性/差异性 |
支持性资料概述 (可以附件形式提供)
|
|
适用范围 |
||||
|
1. |
||||
|
2. |
||||
|
3. |
||||
|
…… |
||||
|
技术特征 |
||||
|
1. |
||||
|
2. |
||||
|
3. |
||||
|
…… |
||||
|
生物学特性 |
||||
|
1. |
||||
|
2. |
||||
|
3. |
||||
|
…… |
表3针对差异性部分的科学证据列表
|
编号 |
证据内容概述 (非临床/临床) |
论证的问题 |
|
1 |
||
|
2 |
||
|
3 |
【附录:等同性判定流程】

来源:Internet


