近日,位于爱尔兰设备制造商Vimeasure宣布,获得总部位于波士顿的Haemonetics的3000万欧元投资。称其该笔资金将用于公司对PerQseal动脉封堵器的研究。
据悉,美国食品药品监督管理局(FDA)已批准公司对其PerQseal动脉封堵器的一项关键研究。该公司从血浆收集系统到输血管理软件,再到血管闭合设备。
1、PerQseal动脉封堵器
据悉,自2016年以来,用于动脉闭合PerQseal设备已获准在欧洲使用。Vivasure表示,在获得CE标志批准的临床研究中,该设备在97%的病例中取得了技术成功,没有出现与设备相关的重大并发症。
而该系统的升级版本PerQseal+是即将进行的试验的重点;它旨在扩大原始技术的覆盖范围,能够处理更复杂的患者解剖结构。
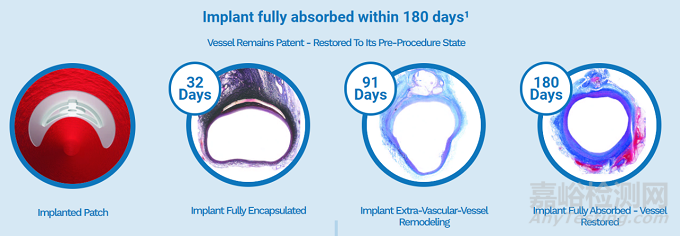
PerQseal系统的设计是用于大孔动脉闭合程序,即密封在经导管主动脉瓣置换术、胸部血管内动脉瘤修复术、放置心脏泵和其他通过血管进行的手术中对动脉进行的穿刺。在32天时植入物完全封装,至91天时植入物在血管外重塑,并在植入后180天内可完全吸收至使血管恢复。
而Vimeasure的技术以植入的贴片为中心,据悉该贴片被放置在动脉内以覆盖穿刺孔。它的合成材料旨在密封开口,一旦愈合,就会被身体完全吸收,这样就不会留下与其他动脉闭合装置相关的缝合线、胶原蛋白或金属植入物。
除了以动脉为重点的技术迭代外,Vimeasure还在开发PerQseal Blue,该技术将用于封闭二尖瓣和三尖瓣修复或更换过程中以及起搏器植入过程中形成的静脉血管孔。
该公司表示,计划将在美国和欧洲招募多达188名患者进行试验。该公司的目标是在今年年底前完成这项研究,之后将把结果发送给美国食品药品监督管理局,以获得该设备的上市前批准。
2、关于Vimeasure Medical
Vimeasure Medical Limited是一家高度创新的医疗设备公司,总部位于爱尔兰戈尔韦欧洲最大的医疗技术中心的中心。
Vimeasure成立于2009年,拥有一家经过ISO 13485认证的完全集成的研发和制造设施。
该公司开发先进的聚合物植入物和输送系统,主要专注于心脏病学、介入放射学和血管外科的微创血管闭合。
该公司由一支经验丰富的医疗器械专业团队组成,他们的专业知识涵盖研究、工程、材料科学、质量、监管、制造、临床和商业等领域。