中医药是我国传统文化的瑰宝,是具有悠久历史传承的医药学体系,包含中医和中药两方面内容。其中,中药是指在我国传统医药理论指导下使用的药用物质及其制剂,按其加工过程可分为中药材、中药饮片、中成药等。中药材(一般指经过净制处理的、除去非药用部位的动植物、矿物等商品药材)经过炮制后成为中药饮片,中药饮片按照中医理论进行配方或者加工成为中成药。中成药狭义指按配方将中药加工或提取后制成具有一定规格,可以直接用于防病治病的一类药品,广义上还包括一切经过炮制加工而成的中药材。
根据国家药品监督管理局相关的公告内容可知,新药是指我国未生产过的药品,增加新增适应证的已生产的药品及改变给药途径或剂型的药品。近年来研究人员主要从中药材的有效部位、有效成分、饮片的配伍等方面入手,不断地尝试中药新药的研发。以下是我国中药新药研发的一些现状:
国家新药注册分类变更,更加重视创新和临床价值
2020年出台的《药品注册管理办法》(国家市场监督管理总局令第27号)对中药注册分类进行了重新规定,新分类与2007年的差别较大。以下为2007年和2020年的中药注册分类具体内容:
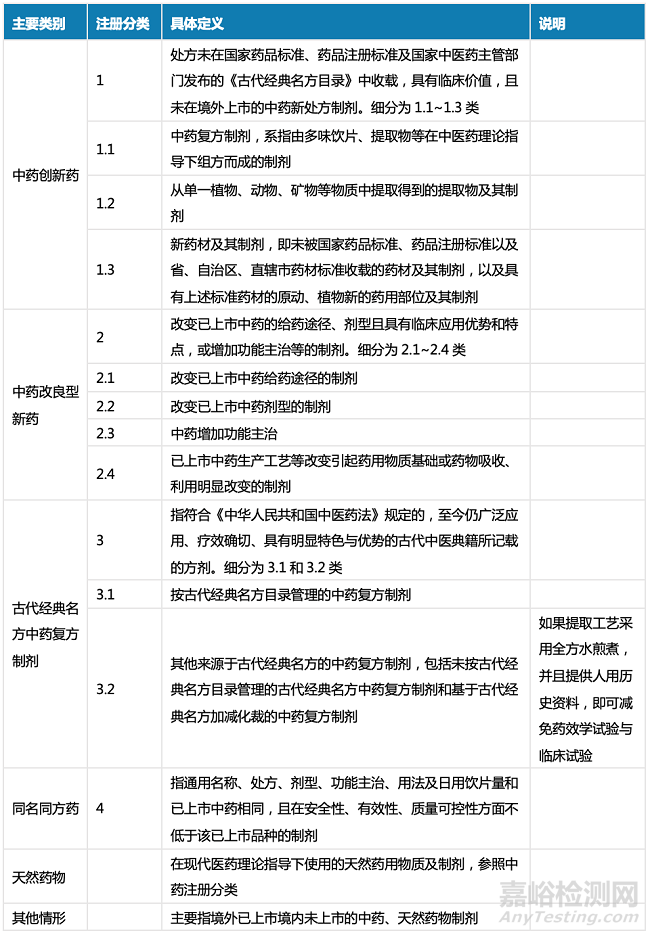
▲ 表1-2007版《药品注册管理办法》中药注册分类
▲ 表2-2020版《药品注册管理办法》中药注册分类
在新的注册分类中,中药创新药对应2007版注册分类(下称“原注册分类”)中的1-6.1类,但两者不完全等同,新的中药创新药以突出疗效为特色,重视临床价值评估,注重满足尚未满足的临床需求;改良型新药对应原注册分类的第7、8类,但同时拓宽了改良型新药范畴,其中“中药增加功能主治”的申报路径由原来的补充申请改为纳入新药申报范畴,以鼓励药品上市许可持有人对已上市中药临床治疗潜力的进行二次开发,做到“老药新用”;“古代经典名方中药复方制剂”单独作为一个注册分类,主要对应原注册分类的6.1类新药,同时拓宽范围,包含未按古代经典名方目录管理的古代经典名方中药复方制剂和基于古代经典名方加减化裁的中药复方制剂,鼓励了业界加强古典医籍精华的梳理和挖掘,进一步发挥中医药原创优势,促进古代经典名方向中药新药转化。
新的中药注册分类更加强调新药的临床优势和创新力度,不仅淡化了原注册分类管理中“有效成份”和“有效部位”含量要求,不再仅以物质基础作为划分注册类别的依据,也强调了要在历史资料的基础上进行创新,完成从历史传承向创新的转化。
新药研发主要来源于古代经典名方及临床经验方中的复方制剂
据《2021国家中药监管蓝皮书》显示,2021年我国批准上市中药新药12个,中药新药获批数量首次突破两位数,超过2017年至2020年获批中药新药数量总和。获批的12个新药均是由“方”变“药”,其中3个来源于古代经典名方,是由在抗击新冠肺炎疫情中发挥重要作用的“三方”实现成果转化的清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒。8个是在临床经验方基础上研制而成,分别为:益肾养心安神片、益气通窍丸、银翘清热片、玄七健骨片、芪蛭益肾胶囊、坤心宁颗粒、虎贞清风胶囊、解郁除烦胶囊。还有一个是在医疗机构制剂基础上研制而成的七蕊胃舒胶囊。
2021年获批的中药新药都来源于古代经典名方和临床经验方,近三年来进入临床试验的中药新药也大多来源于此。按规定在我国进行的临床试验(包含生物等效性试验、PK试验、I、II、III、IV期试验等),均应按要求进行临床试验登记。国家药监局药审中心发布的《中国新药注册临床试验进展年度报告(2021年)》中显示:2019年中药注册临床试验中原注册分类6类(含6类和6.1类)占比最高,为63.1%;2020年以注册分类1类为主,其次为原分类6.1类;2021年以原注册分类6.1为主,占比39.7%;其次为补充申请(指变更研制新药、生产药品和进口药品已获准批文件及附件中载明事项的),占比19.2%。
结合以上数据可见,我国目前的中药新药研发主要源于古代经典名方及临床经验方中的复方制剂。古代经典名方和临床经验方至今仍应用广泛,成分和疗效确切。另在《中药注册管理专门规定(征求意见稿)》中也明确指出:创新药处方来源于经典名方、国医大师或名老中医等具有丰富临床经验的中医临床专家经验方,且提取工艺仅为水提的,可简化工艺研究,豁免非临床有效性研究。这也补充说明,源于古代经典名方和临床经验方的新药比完全创新的新药难度小,步骤少。在困难重重的新药研发工作中,优先从古典名方入手,更有利于加快中药新药研发的进度。
新药临床试验II期持续时间长,成功率不高
申请新药注册需要进行临床试验。临床试验依次进行(除另有规定),分为I、II、III、IV期。2014-2021年国内共开展905项中药相关临床研究,其中每年都是临床试验II期占比最大,结合后一年中的临床试验III期占比可见II期持续时间长,成功进入试验III期的临床试验数量并不多。
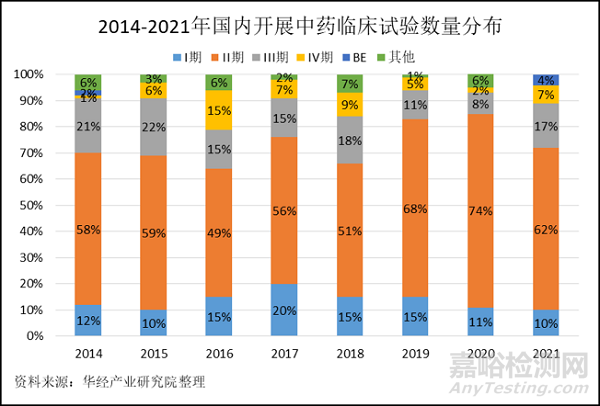
在II期试验中,需要初步评价药物对目标适应症患者的治疗作用和安全性,并给III期试验提供用于确定研究设计和给药方案的依据。
中药蕴含辨证论治的思想,对证用药是中药的根本,因此在临床II期试验中首先要明确的就是证的问题。但长期以来,证的辨明存在很多问题。虽然在2002年出版的《中药新药临床研究指导原则》(试行)中提出,“病证结合”应当是中药新药临床试验的一个显著而主要的特点。在临床试验中,一病一证的结合模式可操作性最强也已经被应用于目前的中药新药临床试验中,但现代医学的病和中医的证之间的关系还没有完全明确化,且还存在无证可辨的情况,一病一证的操作方式也存在一定的局限性。另外证的诊断标准也不严格,量化简单随意,其疗效判定也容易带入主观色彩,没有一个规范化的标准[1]。
此外,药物的有效剂量也要在II期试验中有所结论。虽然定量分析方剂与证之间的相关性已经是一个受关注的问题,但目前还没有合适的研究方法[2]。复方中药新药成分复杂,其剂量与疗效之间很难找到量效关系,因此临床使用剂量的下限也就是界值的确定非常困难。
虽然II期试验中还存在其他的难点如对照实验方案的设计,受试者的招募等,但证及药物界值的确定是当务之急。临床II期中解决这些问题必定会花费较长的时间,且难度较大,成功进入III期的临床试验数量因此也不多。
中药企业在新药研发的投入占比较低
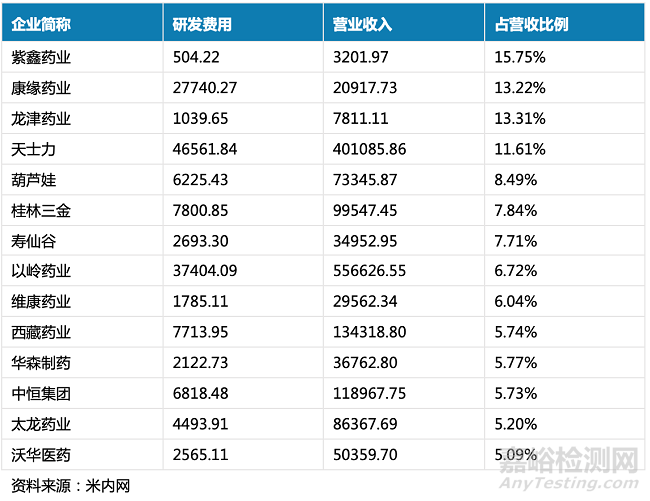
行业通常通过研发费用在营业收入中的占比来看一个企业的研发投入情况。根据2022年上半年的上市中药企业业绩显示,73家A股中药企业上半年研发费用合计超过40亿元,超七成同比均有增长,其中以西藏药业、贵州三力等为代表的12家同比增长超50%。另外,紫鑫药业、龙津药业、桂林三金等14家研发投入比超过5%。虽然中药企的整体研发投入费用有所提升,但结合数据来看,上半年也只有14家上市药企研发投入比超5%,相较于多数投入比都在10%以上的化药生药药企来说,研发投入仍有待提高。
▲ 2022年上半年研发费用占营收比例超5%的A股中药企业(单位:万元)
近年来国家加大了对中药新药的投资和补贴力度,积极支持符合条件的中医药企上市融资和发行公司信用类债券,支持设立中医药产业投资基金,加大对中医药产业的长期投资力度。如广州市政府对在本区内进行科技创新和成果转化,研究开发中药等项目的团队按分类资助500至1500万元不等。未来,中药企可以结合国家和各地地方政府的助力,合理提高自身的研发投入,从而更快推动中药新药的研发。
从上述的几个方面来看,中药新药的研发正在逐步引起重视且已展现出一定的成果。虽然中药新药研发仍存在很多问题,但相关行业都在提供助力,其中不得不提到的就有中药信息化产业链的发展。中药信息化产业涵盖了5个环节:农业(种植)-生产-流通(医疗)-CRO/CMO(研发/药物生产)。每个环节都有大量的优秀企业涌现,如农业信息化有神州信息、超图软件等;生产信息化有药明康德、罗克韦尔等;CRO/CMO有药明康德、康龙化成等。产业链上各环节产业的发展都将助推中药产业链的完善,从而加快我国中药新药研发的进程。相信在不远的未来,我国的中药研发工作一定会进入到快速发展的新局面。
参考文献:
[1]王海南.中药新药临床试验的特点和难点[J].中国中西医结合杂志,2007(07):650-652.
[2]孙占全,刘艳骄,西广成,黄晓华,易建强,黄璐琦.证候与方剂相关性的研究[J].中国中医基础医学杂志,2006(02):150-152.