IVDR 标签 & 说明书
IVDR附录II要求制造商在IVD器械的技术文档中提供“制造商提供的信息”,一般指的是标签和说明书。制造商一定要确保提供的标签和说明书的合规性。
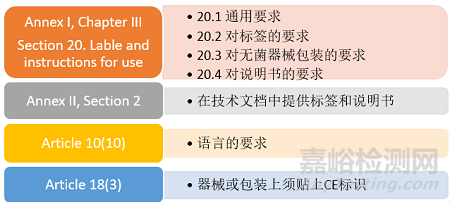
那么在IVDR法规中的哪些章节中提到了对标签和说明书的要求呢?
制造商在准备标签和说明书时,不能仅关注法规对其内容(即识别器械与制造商,与用户或任何其他人有关的任何安全和性能信息)的要求(见附录I,20.2,20.3和20.4),还要关注法规其他条款的要求如通用要求、语言要求等。本次,我们不对具体要求展开解读,强调几个容易被忽视的问题。
通用要求
虽然IVD产品具有多样性,标签的呈现方式也多种多样,但还是要基于这个一般原则,即标签上要求的信息应提供在器械本身上。如果这不可行或不合适,部分或全部信息可以出现在每个单元的包装上。如果给每个单元单独贴全标签不可行,则应在多个器械的包装上列出信息。
如何理解“在器械本身上提供信息不可行或不合适”?参考EN ISO 20417,可以给出答案:
器械的尺寸不允许将该信息固定在器械上;
外表面的性质不允许将这些信息固定在器械上;或
根据ISO 14971:2019,省略这些标识不会对利益/风险平衡产生不利影响。
语言要求
IVDR第10条制造商的一般义务中的第10点提到,说明书和标签应使用预期使用者或患者所在的成员国的官方语言,尤其是自测用途或NPT器械。这里又能衍生出另一个问题,在向公告机构提交产品技术文档时,文档中是否要包含器械目标市场的所有语言的说明书和标签?
答案是不需要。制造商应在技术文档中写明器械预期上市的国家并总结出翻译的过程。在产品上市前,需要将说明书和标签翻译成目标市场所需的所有语言。然而,只要翻译程序有效,在最初提交的文件中只提供一种语言(NB所要求的语言)。
CE标志的要求
CE标志应明显、清晰和不可磨灭地贴在器械或其无菌包装上。如果由于器械的性质不可能贴上或不能保证贴上,则应将CE标志贴在包装上。CE标志也应出现在说明书和销售包装上。IVDR第18条及附录V中规定了使用CE的要求。对于企业而言,最重要的是要使用正确、合规的CE标志。
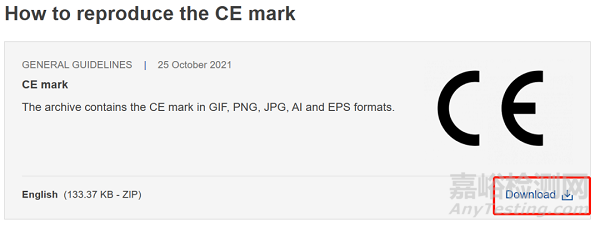
以往不少企业因为不知道CE标志的正规获取途径、为了追求美观随意调整CE两个字母间距等而使用了不合规的CE标志,在审核或流通过程中被发现而引起整改活动。欧盟官方下载链接如下:
CE marking (europa.eu)
https://single-market-economy.ec.europa.eu/single-market/ce-marking_en
下载后记得检查当前使用的CE标志是否正确。
另外,要格外注意,CE标志的各个组成部分应具有基本相同的垂直尺寸,该尺寸不得小于5毫米。对于小型器械,可以免除这一最小尺寸。