近日收到一些关于医疗器械不良事件监测的询问,现就国家关于医疗器械不良事件监测要求进行内容分享。
法规要求:
医疗器械不良事件监测和再评价管理办法(2019年1月1日实施)
医疗器械注册人开展不良事件监测工作指南
医疗器械定期风险评价报告撰写规范
医疗器械注册人开展产品不良事件风险评价指导原则
医疗器械注册人备案人开展不良事件监测工作检查要点
上市许可持有人个例医疗器械不良事件收集和报告指导原则(征求意见稿)
医疗器械不良事件报告范围指导原则(征求意见稿)
医疗器械不良事件重点监测工作指导原则(征求意见稿)
医疗器械再评价工作指导原则(征求意见稿)
医疗器械不良事件定义:
已上市的医疗器械在正常使用情况下发生的导致或者可能导致人体伤害的各种有害事件。
报告原则:
报告医疗器械不良事件应当遵循可疑即报的原则,即怀疑某事件为医疗器械不良事件时,均可以作为医疗器械不良事件进行报告。
报告范围:
导致或者可能导致严重伤害或者死亡的可疑医疗器械不良事件应当报告;创新医疗器械在首个注册周期内,应当报告该产品的所有医疗器械不良事件。
报告途径:
注册为国家医疗器械不良事件监测信息系统用户
系统:http://maers.adrs.org.cn/
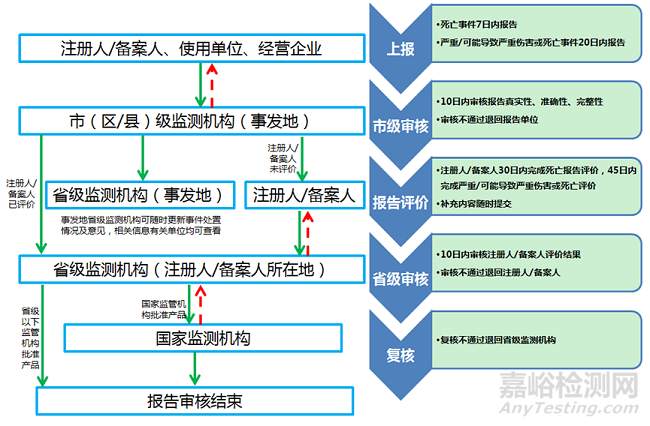
个例不良事件报告流程:
群体不良事件报告流程: