今日头条
豪森长效EPO激动剂获批上市。豪森药业自研创新药培莫沙肽(商品名:圣罗莱)获国家药监局批准上市,用于未接受红细胞生成刺激剂(ESA)治疗的成人非透析患者,及正在接受短效促红细胞生成素(EPO)治疗的成人透析患者(该产品不适用于在需要立即纠正贫血的患者中替代红细胞输注)。培莫沙肽是一种长效的新型多肽类EPO受体激动剂。该新药的第2项适应症上市申请已在去年5月获得CDE受理,适应症为慢性肾脏病(CKD)非透析患者贫血。
国内药讯
1.再鼎引进FcRn拮抗剂获批上市。再鼎医药从argenx公司引进的FcRn拮抗剂艾加莫德α注射液(efgartigimod)获国家药监局批准上市,与常规治疗药物联合,用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者。艾加莫德α注射液旨在减少致病性IgG抗体,阻断IgG再循环过程。2021年12月,FDA批准efgartigimod上市,成为全球首款获批上市的FcRn拮抗剂。
2.驯鹿/信达BCMA靶向CAR-T获批上市。驯鹿生物与信达生物联合开发的靶向BCMA的CAR-T产品伊基奥仑赛注射液(曾用名:伊基仑赛注射液)获国家药监局批准上市,用于治疗至少3线治疗后进展的复发或难治性多发性骨髓瘤(MM)成人患者。2023ASCO年会上更新的Ⅰ/Ⅱ期临床数据显示,中位随访为13.8个月时,总体缓解率(ORR)为 96.0%,12个月PFS率为78.8%(95% CI: 68.6–85.97)。
3.亿腾引进新一代TPO激动剂获批上市。亿腾医药从盐野义制药引进的新一代口服小分子血小板生成素(TPO)受体激动剂芦曲泊帕片获国家药监局批准上市,用于计划接受手术的慢性肝病(CLD)伴血小板减少症的成人患者。在Ⅲ期临床中,与安慰剂相比,芦曲泊帕显著提高患者第8天的有效应答(达到PLT≥50×109/L且较基线升高≥20×109/L,并且未接受过为出血采取的急救治疗的受试者)比例(43.2%vs4.5%)。
4.基石PD-L1单抗食管鳞癌Ⅲ期临床积极。基石药业PD-L1单抗舒格利单抗注射液联合化疗一线治疗无法手术切除的局部晚期、复发或转移性食管鳞癌的Ⅲ期GEMSTONE-304研究成果公布于ESMO GI 2023年会上。与安慰剂联合化疗相比,舒格利单抗联合化疗显著改善BICR评估的无进展生存期(中位PFS:6.2个月vs5.4个月)和总生存期(中位OS:15.3个月vs11.5个月),达到预设双终点。此外,药物总体安全性良好。
5.信达BCMA靶向CAR-T获批临床。信达细胞1类生物制品IBI346获国家药监局临床许可,拟开发治疗复发/难治多发性骨髓瘤(MM)。IBI346是一款靶向BCMA的CAR-T疗法,由P329G BCMA抗体和P329G CAR-T细胞两个部分组成。据悉,信达生物正在华中科技大学同济医学院附属同济医院开展一项评价输注IBI346治疗复发/难治MM的安全性和有效性的开放、单臂临床研究。
6.杭州尚健CD38抗体获批自免病临床。杭州尚健生物自研1类生物制品SG301 SC注射液获国家药监局临床许可,适应症为系统性红斑狼疮。SG301 SC是在SG301注射液(静脉输注)的基础上开发的一款皮下注射给药制剂,可通过多种机制杀伤或者诱导CD38高表达浆细胞/浆母细胞的凋亡,抑制自身抗体的产生。此前,尚健生物开发的SG301注射液(静脉输注)临床适应症为多发性骨髓瘤。
国际药讯
1.A型血友病基因疗法获批上市。BioMarin公司基因疗法Roctavian(valoctocogene roxaparvovec)获FDA批准上市,用以治疗经检测、确认不带有抗腺相关病毒5(AAV5)的抗体的严重血友病A患者(凝血因子VIII [FVIII]活性< 1 IU/dL)。在Ⅲ期试验GENEr8-1中,中位随访时间为3年时,Roctavian治疗组患者年化出血率(ABR)为2.6次年,与其接受常规FVIII预防性治疗时的基线ABR(5.4次出血/年)相比,平均ABR下降了52%。
2.THR-β激动剂NASH适应症报NDA。Madrigal公司潜在“first-in-class”口服选择性甲状腺激素受体(THR)-β激动剂resmetirom已向FDA滚动提交新药申请,用于治疗伴有肝纤维化的非酒精性脂肪性肝炎 (NASH) 患者。在Ⅲ期临床(MAESTRO-NASH)中,与安慰剂相比,resmetirom(80mg和100mg)治疗达到非酒精性脂肪肝活动评分(NAS)降低≥2分,且肝纤维化无恶化的患者比例更多(26%和30%,vs10%);达到肝纤维化至少改善一个阶段,且NAS无恶化的患者比例更高(24%和26%,vs14%)。
3.阿斯利康CTLA-4单抗肝癌Ⅲ期临床积极。阿斯利康CTLA-4抗体Imjudo(tremelimumab)联合PD-L1抗体Imfinzi(durvalumab)一线治疗不可切除肝癌患者的Ⅲ期临床HIMALAYA最新结果将公布于ESMO World GI 2023年会中。四年随访数据显示,与sorafenib相比,Imjudo联合治疗使患者的死亡风险下降22%(HR:0.78,95% CI:0.67-0.92,数据成熟度为78%);患者四年生存率预估达到25.2%(vs15.1%)。在长期随访中未观察到新的安全信号。
4.CD20/3双抗滤泡性淋巴瘤早期临床积极。艾伯维与Genmab联合开发的皮下给药CD20/CD3双抗epcoritamab,在治疗复发或难治性滤泡性淋巴瘤(FL)的Ⅰ/Ⅱ期临床中获积极结果。独立审查委员会评估的总缓解率达到82%,超过预先设定的疗效阈值。详细结果将在医学会议上公布。今年5月,该新药已获得FDA批准上市,用于治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)。
5.诺华25亿美元出售眼科资产给博士伦。诺华宣布已与博士伦达成协议,将其部分眼科资产剥离给博士伦,交易总额高达25亿美元,预计2023年下半年完成。本次剥离的资产包括已上市的干眼症药物Xiidra、慢性眼表疼痛在研药物SAF312 (libvatrep)、AcuStream给药装置使用权利以及处于临床前开发阶段的第二代TRPV1拮抗剂OJL332等。根据协议,诺华将获得与Xiidra、SAF312和OJL332的未来销售相关里程碑付款,金额高达7.5亿美元。
6.礼来收购糖尿病细胞疗法公司Sigilon。礼来宣布以总金额约为3.096亿美元收购细胞疗法公司Sigilon。该公司利用其专有Afibromer™生物材料基质包裹技术开发的封装细胞疗法,能够保护细胞免受免疫排斥,在植入体内后也不会引发组织纤维化,用于治疗糖尿病、内分泌异常等疾病。2018年,礼来与Sigilon公司达成合作协议,共同开发用于1型糖尿病治疗的封装细胞疗法,包括SIG-002。
医药热点
1.“十四五”全国规划配置大型医用设备3645台。近日,国家卫健委印发《关于发布“十四五”大型医用设备配置规划的通知》,明确“十四五”期间,全国规划配置大型医用设备3645台,其中甲类117台、乙类3528台。《通知》要求,各地要严格执行规划数量布局,科学把握配置标准;为社会办医配置预留合理空间;认真履行行政许可程序,严格评审要求,规范审批行为。
2.北京协和医学院天津医院(一期)项目交付。近日,位于天津健康产业国际合作示范区内的北京协和医学院天津医院(一期)项目正式交付。协和天津医院项目总投资约50亿元,规划总床位数不低于1800张,总建筑面积36万平方米。其中项目一期设置床位1000张,建筑面积16.4万平方米。项目建成后,将与天津健康研究院、细胞生态海河实验室等进行全维度强强联合,打造形成“协和天津”的品牌和声誉。
3.广西实行全区异地就医结算“免备案”。广西壮族自治区医保局近日召开新闻发布会,宣布从7月1日起,广西职工基本医保(含生育保险)和城乡居民基本医保参保人员在参保统筹地区外、自治区内定点医药机构异地就医,将实行“免备案”管理服务。参保人员可自主选择在自治区内所有定点医药机构就医购药,相关医疗费用按参保地就医报销比例执行。参保民众不用承担因未办理备案而降低报销比例的费用,由医保基金进行支付。
评审动态
1. CDE新药受理情况(07月02日)
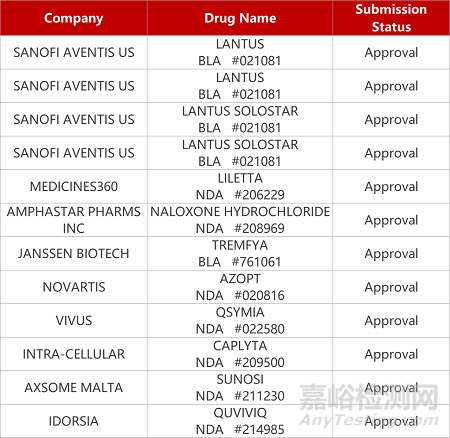
2. FDA新药获批情况(北美06月29日)