今日头条
信达哮喘新药启动Ⅰ期临床。信达生物在Clinicaltrials.gov网站上注册一项IBI3002用于健康受试者和中至重度哮喘成人患者的Ⅰ期临床试验。这是一项随机、双盲、安慰剂对照的单剂量递增研究,拟评估IB13002的安全性耐受性、药代动力学和药效学,以及治疗中重度哮喘的初步疗效。预计2025年2月完成。据悉,信达生物尚未对外公开IBI3002的靶点。
国内药讯
1.百济神州PD-1单抗新适应症报产。百济神州PD-1抑制剂替雷利珠单抗新适应症上市申请(sBLA)获CDE受理,用于可切除非小细胞肺癌(NSCLC)患者的围术期(覆盖新辅助+辅助)治疗。在Ⅲ期RATIONALE 315研究中,与安慰剂联合化疗相比,替雷利珠单抗联合化疗用于新辅助治疗显著提高了MPR(主要病理学缓解)率(56.2%vs15.0%)和pCR(病理学完全缓解)率(40.7%vs5.7%)。
2.恒瑞TROP2-ADC启动II/III期研究。恒瑞医药靶向TROP2的ADC新药SHR-A1921在clinicaltrials.gov网站上注册一项III期临床试验,拟评估SHR-A1921对比铂类双重化疗治疗复发性上皮性卵巢癌患者的有效性与安全性。在I期研究中,SHR-A1921治疗实体瘤达到33.3%的客观缓解率,疾病控制率为80%。去年12月,科伦药业开发的国内首款Trop-2 ADC新药SKB264上市申请已获得CDE受理,用于三线治疗局部晚期或转移性三阴性乳腺癌。
3.博锐CD3/HER2/HER2三抗获批临床。博锐生物与成都恩沐联合开发的三特异性抗体BR115注射液(CMG6A19)获国家药监局临床许可,拟开发用于治疗HER2阳性实体瘤。BR115可特异性结合肿瘤细胞表面的HER2 ECD2和HER2 ECD4,并同时与T细胞表面的CD3分子结合,从而将T细胞募集到靶细胞附近,重新定向T细胞的杀伤作用,诱导T细胞活化,裂解靶细胞。博锐拥有CMG6A19在大中华区的开发、生产以及商业化权益。
4.神州细胞CD38单抗获批I期临床。神州细胞自主研发的1类生物药SCTC21C注射液获国家药监局批准开展I期临床研究,拟评估用于治疗CD38+血液瘤的安全性与初步疗效。SCTC21C是一款经Fc段改造、靶向CD38的单抗药物,可增强对CD38+肿瘤细胞的杀伤作用。临床前研究显示,SCTC21C具有良好的临床前药代动力学和安全性结果。
5.元宋生物溶瘤病毒国内报IND。元宋生物1类生物制品重组L-IFN腺病毒注射液(YSCH-01)临床试验申请获CDE受理。YSCH-01利用具有靶向肿瘤双重调控的溶瘤腺病毒载体携带了抗癌多功能的重组免疫抗癌基因L-IFN,已在临床前多个实体肿瘤类别研究中显示出90-100%的抑瘤效果。去年年底,该新药已获FDA批准开展新药研究。
国际药讯
1.AZ补体因子D抑制剂获批上市。阿斯利康“first-in-class”口服补体因子D抑制剂Voydeya(danicopan)获日本厚生劳动省批准上市,联合标准治疗药物C5抑制剂Ultomiris或Soliris治疗阵发性睡眠性血红蛋白尿症(PNH)。Voydeya阻止C3b片段在患者血红细胞上的沉积,控制PNH患者红细胞分解与血管外溶血,进而改善患者的治疗效果。在III期ALPHA临床中,与安慰剂相比,danicopan联合治疗显著改善患者血红蛋白水平较基线的变化(2.94[0.211]g/dLvs 0.50[0.313]g/dL)。
2.Novocure公司肿瘤电场疗法报新适应症。Novocure公司肿瘤电场治疗(TTFields)的新适应症上市申请获FDA受理,联合标准治疗(SOC)用于二线治疗非小细胞肺癌(NSCLC)患者。TTFields旨在通过多种机制施加物理外力以抑制肿瘤细胞有丝分裂进而抑制其生长。在III期LUNAR研究中,与标准治疗相比,TTFields联合标准治疗显著提高患者的总生存期(中位OS:13.2个月vs9.9个月,HR:0.74,P=0.035)。再鼎医药拥有TTFields的中国权益。
3.MAIA公司端粒靶向抗癌药肺癌Ⅱ期临床积极。MAIA公司端粒靶向药物THIO治疗非小细胞肺癌(NSCLC)经治患者的Ⅱ期研究THIO-101结果积极。THIO可诱导产生端粒酶依赖性端粒DNA修饰、DNA损伤反应和选择性癌细胞死亡。临床数据显示,作为二线和三线治疗时,THIO联合PD-1单抗cemiplimab的初步疾病控制率分别达到100%和88%。此前,该药物曾获得FDA授予孤儿药资格(ODD)。
4.Coherus公司IL-27单抗肝癌II期临床积极。Coherus公司IL-27单抗casdozokitug(casdozo)联合PD-L1抑制剂阿替利珠单抗和贝伐珠单抗(bev)治疗局部晚期或转移性肝细胞癌(uHCC)的II期临床结果积极。根据RECIST v1.1评估,casdozokitug联合治疗达到客观缓解率为38%,中位无进展生存期为8.1个月,疾病控制率为58.6%。Coherus计划在临床试验中评估casdozo联合PD-1抗体toripalimab和bev组合的治疗效果。
5.现货型CAR-NK疗法早期临床见刊《自然》子刊。MD安德森癌症中心研究人员开发的源于脐带血、工程化表达CD19靶向CAR与白细胞介素-15(CAR19/IL-15)的CAR-NK细胞疗法,在治疗CD19阳性B细胞恶性肿瘤患者的Ⅰ/Ⅱ期临床获积极结果。数据显示,患者在第30天和第100天的总缓解率均为48.6%;1年总生存率和无进展生存率分别为68%和32%;试验中没有观察到明显的毒性。详细结果公布于《自然》子刊(MDNature Medicine)上。
6.CD19靶向CAR-T治疗MS获快速通道资格。Kyverna公司靶向CD19的自体CAR-T疗法KYV-101获FDA授予快速通道资格,用于多发性硬化(MS)的治疗。KYV-101旨在深度诱导血液循环和组织实现B细胞完全耗竭,对B细胞驱动的自身免疫性疾病(如狼疮性肾炎、系统性硬化症和炎性肌病)具有治疗潜力。此前,FDA已授予KYV-101快速通道资格,用于治疗难治性狼疮肾炎(LN)和重症肌无力(MG)。
医药热点
1.章轲履新国家医保局党组书记。据国家医保局网站消息,1月20日上午,中央组织部有关负责同志出席国家医疗保障局领导干部会议,宣布中央决定:章轲同志任国家医疗保障局党组书记。公开信息显示,章轲,男,汉族,1968年5月出生,中共党员,研究生学历,管理学博士学位。此前,章轲任审计署党组成员、副审计长。
2.中山六院关节外科/运动医学科开科。1月18日上午,中山大学附属第六医院关节外科/运动医学科正式开科。宋斌副主任表示,关节外科/运动医学科将秉承“守真传承、求真创新”精神和“三创三服”文化核心理念,力争经过5-10年的建设,将科室打造成为国内一流、华南地区规模最大、涵盖预防、治疗、康复、教学、科研、转化为一体的全流程骨关节运动医学品牌。
3.瑞士CDMO公司裁员218人。瑞士CDMO公司龙沙(Lonza)宣布永久关闭加州Hayward工厂(生物治疗药物、生物试剂和生物材料的生产基地),并裁员218人,裁员将于2月2日生效。这是由于CDMO市场需求主要集中在临床和商业产品的结合和整合上,而Hayward基地提供的增长机会有限。去年10月,Lonza与其生物制药合作伙伴扩大合作,在位于瑞士Stein的工厂建立一条专用的商业灌装线。作为该项目的一部分,龙沙增加约115个工作岗位。
评审动态
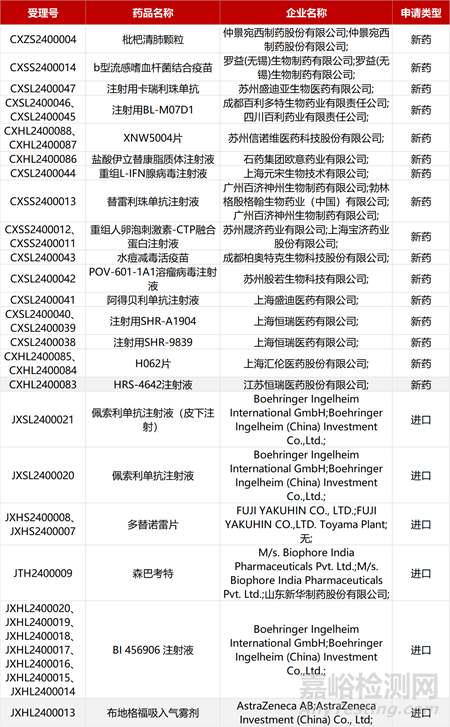
1. CDE新药受理情况(01月20日)
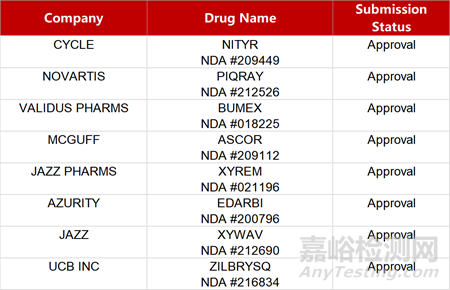
2. FDA新药获批情况(北美01月18日)