本文导读
本文收集了美国FDA批准上市鼻喷雾剂产品中鼻脑给药相关产品的说明书信息,并对比分析了不同品种说明书信息间的共性和差异,为未来国内鼻用制剂的开发提供参考。
1、 FDA说明书的主要内容
美国FDA在药品说明书和标签等方面的监管要求较为完善,处方药说明书由要点、目录和处方信息3个部分构成。处方信息中的临床药理和临床试验部分是新药研发的关键信息,产品获批后上市后临床试验的相关信息也应更新补充于说明书中。
需注意的是,FDA已批准的鼻脑给药相关鼻喷雾剂产品中,特殊人群除常规的孕妇及哺乳期妇女、儿童、老人和肝肾功能不全人群外,还包括呼吸功能受损人群。此外,产品说明书的最后一部分提供了详细的药物准备、给药、操作、贮存和处理等信息,并附有关于使用方法的详细图文解释,便于患者了解使用。
2、 FDA批准的鼻脑给药相关鼻喷雾剂产品
经对FDA药品数据库检索发现,截至2023年8月,共有15个鼻脑给药相关的鼻喷雾剂产品。
FDA批准的鼻脑给药相关鼻喷雾剂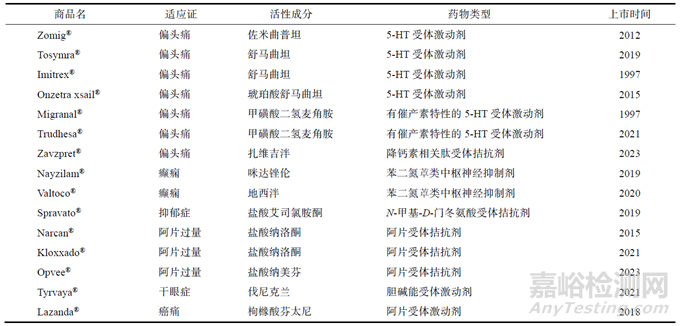
3、非临床安全性评价与说明书中载录信息
在已获FDA批准的鼻脑给药途径相关鼻喷雾剂产品中,1个产品属于新分子实体,1个属于新活性成分,其他均为已有活性成分的改剂型或新制剂/新生产商产品。通过说明书载录信息可以看出,对于不同类型的产品,非临床安全性评价的策略与研究内容各有差异。
Zavzpret®是采用新分子实体的一类NDA鼻脑给药制剂,其非临床评价较完整。说明书中载录的非临床毒理信息包括鼻内给药的致癌性试验、体内和体外遗传毒性试验,在生殖毒性试验中为增加系统暴露量采用了皮下给药。在该品种的毒性评价中,由于鼻内给药后系统暴露量低,因此在大鼠和猴中增加了皮下给药途径,同时使用了鼻表面积归一剂量(局部毒性)与血浆暴露系统毒性确定安全范围。
Spravato®是采用新活性成分的二类NDA鼻脑给药制剂,活性成分为盐酸艾司氯胺酮,其注射剂作为全身麻醉剂已有长期用药历史。在Spravato®的非临床安全性评价中包括了安全药理学、大鼠与犬中的长期鼻内给药毒性试验、鼻内给药生殖毒性评价、体外和体内遗传毒性试验、神经毒性试验(鼻内与皮下给药)、致癌性试验等,其中致癌性试验分别使用了鼻内给药(大鼠)与皮下给药(转基因小鼠)。
相对于新分子实体,改剂型产品的非临床评价更加遵循“具体问题具体分析(case by case)”原则,可以引用活性分子原剂型品种的已有信息,但仍需要根据品种特性开展针对性评价。FDA《改变制剂处方和变更给药途径的非临床安全性评价技术指导原则》中提出,对于改变给药途径的鼻内给药品种推荐进行拟用途径开展单次和/重复给药毒性试验,包括完全的组织病理学检查,其中短期研究(2~4周)应包括2个物种,包括至少1种非啮齿类,在最合适物种中进行长期(可达6个月)研究,具体给药时间一般遵循ICH M3或ICH S9的建议。本文以近年批准的伐尼克兰、盐酸纳美芬为例,分析其非临床评价与说明书载录信息。
鼻喷雾剂伐尼克兰Tyrvaya®的活性成分为酒石酸伐尼克兰。作为新分子实体,酒石酸伐尼克兰片Chantix于2006年获批(现已退市)用于尼古丁成瘾的辅助治疗。在Tyrvaya®的非临床评价中,遗传毒性、致癌性、生殖毒数据均引用了Chantix的已有数据,另开展了兔28 d重复经鼻给药、大鼠28 d重复经鼻给药、兔6个月鼻内滴注给药伴随毒代分析,并在长期给药毒性试验中同时评价了眼、鼻毒性。
盐酸纳美芬鼻喷雾剂Opvee®的活性成分为盐酸纳美芬,其注射剂Revex®于1995年作为NME获批(现已退市)。申请人在犬中评价了鼻内给药对心血管系统和呼吸系统的安全药理学,分析了口服(大鼠)与静脉(兔)重复给药的药动学(pharmacokinetics,PK)特征,在犬中进行了单次鼻内给药的毒性和毒代分析,在大鼠与犬中开展了28 d重复经鼻给药伴随毒代分析,并在重复给药试验中评价了局部耐受性。通过PK数据,桥接了Revex®的生殖和发育毒性数据,Opvee®说明书中载录的生殖毒性数据包括了大鼠与兔口服、兔静脉给药数据,未开展致癌性评价(该品为单次给药)。由于Opvee®中使用了新辅料十二烷基麦芽糖苷,申请人还根据指导原则开展了对新辅料的相关评价,部分数据引用自新辅料的药物主文件(drug master file,DMF)。
由上述分析可以发现,对于改变给药途径的新制剂,由于靶点和作用机制等信息较为明确,可以借鉴、引用或桥接具有相同活性成分药品的已有研究资料,同时对于新的给药途径的新制剂则需开展必要的毒理学研究,并评价局部刺激性,局部刺激性评价可以在重复给药等试验中伴随开展。
4、临床研究情况
通过对FDA批准的不同类型鼻脑递送产品的临床研究开展情况的分析,可以看出申报类型为新分子实体及新活性成分时都进行了相对完整的安全性和有效性研究,而在已有活性成分改剂型品种的临床研究中,均会引用已有制剂的研究数据。
新分子实体Zavzpret®说明书中详细列出了支持其安全性和有效性的4项临床研究数据。基于品种对药物本身特性、内在和外在影响因素进行了有效性和安全性的综合评价。
对于含有新活性成分的Spravato®,虽然消旋体氯胺酮注射液在临床上已被广泛使用,但Spravato®与原有品种在适应证、剂型、规格、用法用量、给药途径、使用人群等方面均不同,对不同角度的PK、药效学(pharmacodynamics,PD)、多个内在和外在安全性影响因素均进行了独立的临床药理研究。Spravato®说明书中除了“药物滥用”和“依赖性”部分引用氯胺酮注射液的已有数据外,其余数据资料均来源于自身的临床试验。
改良型新药因具有研发风险低,回报率高和生命周期长等优势,已成为新药研发的热点方向。其中,鼻喷雾剂伐尼克兰Tyrvaya®正是以原研药酒石酸伐尼克兰片的3类NDA途径申报获批。该品种基于与口服制剂的相对生物等效性试验结果,在直接鼻内喷雾制剂和口服制剂之间建立了PK桥接。在该品种的临床药理研究中,除了上述生物利用度研究,进一步开展了2项多剂量、随机对照研究,对1个主要终点(泪试验评分)和2个次要终点(眼干燥评分、角膜荧光素染色评分)进行评估,以实现剂量探索研究并对有效性和安全性进行了验证;还针对主要终点(泪试验评分)开展了12周的长期安全性临床评价。
另外,Opvee®鼻喷雾剂和Revex®注射剂之间建立临床数据桥接后,申请人围绕剂量与给药途径、起始治疗、持续时间及稳定阿片类药物激动作用下的药物效应开展了2项PK和1项PD研究。
不同申报类型及同一类型但不同品种间鼻脑给药鼻喷雾剂说明书中临床研究数据的来源均存在差异。具体情况与活性成分的药理数据、已有研究的可桥接性、产品的安全性和风险可控性等因素有关。
5、与给药方式相关的不良反应
药物在体内的吸收、分布和起效时间随给药方式的变化而变化,因此除药物的药理作用、剂量和剂型等因素外,药品的不良反应也与给药方式密切相关。鼻腔给药是一种非侵入式给药方式,但其在患者体内的PK特性与静脉给药相似,因此可作为一种注射给药的替代方法,用来改善患者的用药依从性,同时可以避免与注射点反应有关的不良反应,以舒马曲坦为例,见下表。
说明书载录的舒马曲坦不同给药方式的不良反应
与口服制剂相比,鼻脑给药制剂的脑部靶向性更好,生物利用度更高,能降低药物的肝肾毒性和全身不良反应,以佐米曲普坦为例,见下表。
说明书载录的不同给药方式佐米曲普坦的不良反应
味觉异常、鼻腔不适和鼻腔/鼻窦功能紊乱等鼻腔反应是鼻脑给药制剂所特有的不良反应。除了这些与鼻局部功能有关的不良反应外,鼻脑给药制剂的不良反应一般与其已上市的注射或口服制剂产品相似。
值得注意的是,与口服片剂相比,佐米曲普坦的鼻脑制剂新增了胸痛、胸闷、胸紧和胸口沉重等心血管不良反应,但根据舒马曲坦说明书,其鼻脑制剂避免了其皮下和口服剂型的相关心血管不良反应。
另一方面,同一药物不同产品的鼻腔不良反应存在不同,见上表。这可能与不同鼻喷装置的喷雾特性有关,也可能与给药操作步骤中呼吸配合要求和喷头朝向要求的不同有关,见下表。
舒马曲坦鼻脑制剂关键给药操作要求对比
6、小结
鼻喷雾剂在技术上属于药械组合产品,与传统口服制剂相比,其给药方式更加复杂,需在说明书中加入额外的装置使用指导信息。本文对FDA批准的鼻脑给药途径相关鼻喷雾剂的说明书内容进行了汇总分析,对比了不同注册类型的非临床和临床研究信息内容和不良反应,以期为未来国内鼻脑制剂的开发及说明书撰写提供参考。鼻脑制剂的研究者或注册申请人在开展相关研究前,应根据相关法规和指导原则进行科学试验设计,还可参考已上市同类药品的说明书信息,必要时向审评部门申请沟通交流,以制定更加科学合理的研究计划。
来源:郑淇文,高静,梅蕾蕾,崔雪子,陈一飞.美国FDA批准鼻脑给药相关的鼻喷雾剂说明书分析[J].中国现代应用药学,2023,40(20):2872-2877.








