您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2024-08-31 21:01
2021年3月18日,中华人民共和国国务院发布了《医疗器械监督管理条例》,加强了对医疗器械全生命周期的监管,加大了对违法违规行为的惩处力度,同时对医疗器械的监管提出了新要求[1]。有源医疗器械是指任何依靠电能或其他能源而不是直接由人体或重力产生的能量发挥其功能的医疗器械,如医用超声诊断仪、心电图机、红外额温枪、电子体温计、电子血压计等。《医疗器械监督管理条例》[1]、《医疗器械生产质量管理规范》[2]、《医疗器械生产质量管理规范现场检查指导原则》[3]、《医疗器械生产监督管理办法》[4]等是对企业进行现场检查的依据。本研究中对2021年至2022年江西省药品检查员中心日常监督检查的83家次有源医疗器械生产企业现场检查的缺陷项情况进行汇总与分析,以找出企业生产质量体系管理普遍存在的问题,为日常监管提供数据支持,为企业质量管理提供参考。现报道如下。
1、 现场检查缺陷项总体情况
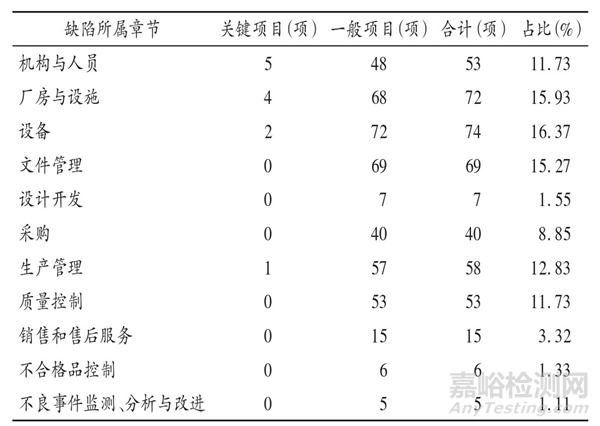
共发现不符合项目452项,包括关键项目12项和一般项目440项,缺陷项目主要集中于机构与人员、厂房与设施、设备、文件管理、采购、生产管理、质量控制等方面。详见表1。
2、 现场检查发现问题与分析
2.1 机构与人员
有源医疗器械生产企业机构与人员部分发现的缺陷项占比较高(11.73%)。主要问题有以下6个方面。
1)生产负责人对产品焊接生产工艺不熟悉;2)质量负责人对产品检验过程、产品具体检测技术及操作规程不熟悉;3)生产负责人已离职,企业未重新聘任;4)企业生产人员不足;5)企业无专职检验人员;6)生产检验人员培训不到位。
表1 现场检查缺陷项分布(n=452)
Tab.1 Distribution of defects during the on-site inspection(n=452)
2.2 厂房与设施、设备
厂房与设施、设备部分现场检查发现问题占比最高(32.30%)。厂房与设施、设备是有源医疗器械生产企业组织生产的重要资源,应保证根据产品的特性和工艺流程进行合理设计、布局和使用[5],应配备与生产产品规模相匹配的生产设备、工艺装备,确保生产有效运行。主要问题有以下6个方面。
1)未配备产品相匹配的生产设备。生产车间红外额温计生产线已被拆除,不能确保生产有效运行。
2)生产设备操作规程、操作记录、维护保养记录和设备状态标识缺失。(1)未建立车床的清洁、维护和维修的操作规程;(2)未保存输液器检漏机的操作记录;(3)未保存高速精密旋转车床的设备维护、维修记录;(4)车间内热风枪、数字示波器无设备状态标识。
3)无检验场所和设施。(1)企业已拆除实验室,现场检查时未发现检验场所;(2)企业将检验场所租赁给其他公司。
4)厂房布局和使用不合理。(1)企业已将原有电动病床原材料库和成品库拆除,现场检查时未发现原材料库和成品库;(2)生产车间用于堆放桌椅、文件柜等公共用品。
5)仓储区管理不规范。(1)物料仓库合格品货架存放检验不合格的电阻式触摸屏、柔性电路板接线等物料;(2)物料中的部分光学和电学物料有特殊的存储要求,仓库内无温湿度控制设施;(3)仓库未安装挡鼠板,不能防止老鼠或其他动物进入。
6)生产环境不整洁。(1)生产车间留有茶杯、茶叶等生活物品;(2)生产区操作台粉尘多。
2.3 文件管理
质量管理体系文件是现场检查中对企业质量管理进行审查的主要依据。企业应按实际情况编写技术文件和记录,现场检查时应重点对企业管理制度、程序文件、生产记录进行审核,避免实际操作和质量文件不符的情况[6]。主要问题有以下3个方面。
1)文件未及时更新。(1)生产操作文件未及时更新,《绕线机操作规程》已不适用于目前生产使用的绕线机;(2)医院电动车注册证中型号规格、结构组成及产品技术要求变更,但产品主文档未及时更新。
2)记录可追溯性不强。(1)耐压测试仪使用记录中未记录测试品的名称、型号和批号信息;(2)进货检验记录中未记录产品批号、零件图号等信息。
3)未对受控或作废文件进行标识。(1)检测规范文件均盖有受控章,但均为过期失效文件;(2)操作规程文件无版本号、实施日期、审核人签名等信息,未加盖受控标识。
2.4 生产管理
企业应按建立的质量管理体系生产符合产品技术要求的医疗器械产品,制订生产工艺规程、作业指导书等,并确保生产记录满足完整和可追溯要求。生产管理现场检查缺陷项占12.83%,主要问题有以下4个方面。
1)生产记录不完整。(1)医院电动床批生产记录领料单中未记录原材料批号;(2)医用空氧混合器主件批生产记录中未记录产品名称、规格和型号。
2)未对生产的特殊过程确认并保存记录。(1)未对生产电动病床的特殊过程表面处理(除油、清洗、除锈)进行确认并保存相应记录;(2)未提供透镜组件装配和组件装配所涉紫外线粘结固化工序过程的确认记录。
3)未对生产环境进行监测。(1)生产车间未配备温湿度计;(2)未提供生产车间的温湿度记录。
4)生产操作未遵循产品防护要求。(1)在安装主板时,操作工未佩戴防静电手腕带;(2)原料仓库内部件的“金手指”部分裸露在外,未按要求使用防静电袋包装;(3)无线掌上彩超成像诊断系统生产工作台未安装防静电设施。
2.5 质量控制
质量管理是体系中重要的组成部分,重点检查企业对产品的检验、放行和留样情况,主要问题有以下3个方面。
1)检验记录内容不完整。(1)宫颈细胞学扫描图像分析系统检验记录中未记录介电强度项目下加强绝缘的检验结果;(2)额温枪检测报告中未记录最大允许误差、温度显示范围等技术指标的原始检验数据;(3)X射线骨密度仪检验记录中只有骨密度的计算结果,未保留原始测量数据。
2)未定期对检验仪器校准。(1)未校准实验室电子天平;(2)现场无法提供接地电阻测试仪、泄漏电流测试仪校准证书。
3)未按规定留样和保存记录。(1)未按文件进行留样且留样室堆满杂物;(2)未提供光谱治疗仪的留样观察记录;(3)未建立留样台账。
2.6 采购
有源医疗器械产品需采购电子元器件,原材料的质量好坏将直接影响最终产品的质量,主要问题有以下3个方面。1)未保留电子物料供应商评价结果和记录;2)采购记录不完整,无法提供原料的检验报告及验收标准,缺少供应商的资质证明文件;3)采购合同未明确电子物料的性能指标。
2.7 设计开发
设计开发是形成医疗器械固有质量特性的主要过程,企业应对设计变更引入的风险进行评估,必要时开展验证和确认,以确保产品质量[5]。主要问题有以下2个方面。1)医用中心制氧系统主机外观喷涂生产工艺由喷壶改为手动滚刷,而企业未提供对该变更的评审、验证和确认记录;2)因产品运输包装的特殊要求,企业增加了振动测试的生产工序,但未记录该工艺变更情况。
3、 对策与建议
3.1 落实企业主体责任及加强法规培训
风险管理、全程管控、科学监管、社会共治是药品、医疗器械、化妆品治理的基本原则。2022年12月29日,国家药品监督管理局发布了《企业落实医疗器械质量安全主体责任监督管理规定》[7],明确了医疗器械生产企业在质量安全管理方面的义务和责任,摆脱“保姆式管理”模式[8]。强化企业产品质量全生命周期管理,严格落实企业主体责任,提升企业主体责任意识,确保产品安全有效和质量可控,对有效维护公众健康具有重要意义。应结合医疗器械产品特性和风险特点,深入开展法律法规和安全生产教育培训,确保企业生产人员理解并掌握法律法规、技术规范、工作要求,不断提高法律意识和技术水平[9]。
3.2 建立科学、合理的监管机制
医疗器械产品涉及的学科广泛,产品分类复杂,风险特点不一,应结合医疗器械产品特点和风险程度,制订科学、合理的检查计划,采取不同的检查方式和内容,明确检查工作重点,有的放矢,重拳出击,及时排除风险隐患。监管部门应不断创新监管方法,充分运用大数据的先进理念、技术和资源,构建医疗器械注册检验、技术审评、审批发证、监督检验等一体化的大数据监管模型,汇总数据,并进行关联分析[10],把握医疗器械产品的质量风险、规律和特征,有效提高监管部门的风险预防能力,建立科学监管机制,保障产品的质量安全[11,12]。
3.3 强化职业化检查员综合能力
职业化医疗器械检查员是日常监督的重要力量,应按照“四个最严”开展检查工作。在检查中,及时指出企业存在的问题,督促企业不断提高质量管理能力。结合企业实际情况开展无菌、义齿、有源、体外诊断试剂等专题培训[13],并与现场实训相结合,提高检查员对法规的理解,不断提高检查员监督、执法和服务的能力。同时,加强职业化检查廉政教育和日常评价考核制度,做到检查廉洁自律、奉公执法,考核奖惩分明、科学合理[14,15]。


来源:中国药业


