您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-06 12:28
主要原材料供应商变更到底需不需要变更注册呢?这个问题,国内法规未直接明确,但企业的现实是:从设计开发到商业化生产,一定会有各种变更,当然也包含供应商的变更。相信很多企业都被这个问题烦忧过。今天笔者就跟各位分享一下自己的见解。
首先,我们看看国内的医疗器械法规:已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续;发生其他变化的,应当按照国务院药品监督管理部门的规定备案或者报告。
重点是【实质性】变化,而这个变化,是谁来判定呢?其实是企业自己!比如医疗器械飞行检查缺陷案例显示:
①熔喷布、无纺布、内包装袋等A类物料供应商发生变化时,未开展熔喷布、无纺布的生物学评价以及内包装袋封口、灭菌、解析等工艺验证的设计更改评审、验证和确认。
②企业的“钳夹牙垫”由自制变更为外协生产,且内外管原材料供应商发生改变,但均未提供相应的评审记录。
③企业原材料猪眼球供应商进行过变更,但设计开发文档中未对设计和开发更改进行评审并在实施前得到批准。
看到这三条,各位读者是否觉得很严重呢?好像是又好像不是!因为这三条都是一般不符合项。是不是很疑惑?
第一条、第二条供应商发生变化,通过开展各种评价对比,证明它是【非实质性】变化,也许很多读者能理解。但是第三条原材料猪眼球,这一看就是动物源性啊,它怎么能够不属于【实质性】变化呢?
其实笔者也一直在想:也许企业已经进行过变更注册了,只是体系细节疏忽了。但仔细一想,又不对。因为,如果企业进行了变更注册,这种“实质性”变更一定会有现场核查,而现场核查又怎能查不出企业【未对设计和开发更改进行评审并在实施前得到批准】呢?所以这家企业大概率是按照设计开发变更流程自行变更了,也许企业的变更评估做的很到位,各种验证、生物学评价、甚至病毒灭活都做的很全面,都能证明它是【非实质性】变化,所以就按照体系要求自行变更了,变更过程可能出现了粗心,导致个别细节没跟上。所以最终在飞检判定中它属于一般不符合项。
笔者还查阅了近几年的飞检案例,都可以证明,原材料猪眼球供应商的变更是企业自行控制的,如果申请了注册变更,那么飞检判定中,大概率会这么写缺陷:脱细胞角膜基质进行了原材料猪眼球的变更注册,但企业未对设计和开发更改进行评审并在实施前得到批准。
法规中的原材料发生实质性变化,应向原注册部门申请变更注册手续,到底指的是什么呢?笔者认为法规指的是原材料本身,比如重组胶原蛋白,A供应商和B供应商,虽然都是重组胶原蛋白,但它的表达体系、DNA模板种属、氨基酸长度和编辑情况都不一样,所以这种原材料,不同的供应商生产出来的原料一定是不同的,所以风险就不同,就需要需要申请变更注册,除非你能证明它的结构组成是一致的。
当然主要原材料供应商发生【实质性】变化也分为两种,一种是我们刚才讲的:自行对变更情况进行研究及质量控制;一种则是:按首次注册进行申报,如国家药监局器审中心2020年的答疑【生产商变化导致抗原抗体发生实质变化、引物探针序列变化等,属于产品设计发生重大改变,以上变化应按首次注册进行申报】。
而非实质性变化呢,除了满足内部的质量体系要求外,还要依据国家药监局发布的《医疗器械注册与备案管理办法》第79条:在变化之日起30日内向原注册部门备案。而备案方式又要依据各省药监局自己的规定,如河北省,非实质性变更应当在河北省医疗器械监管系统中进行上报说明。
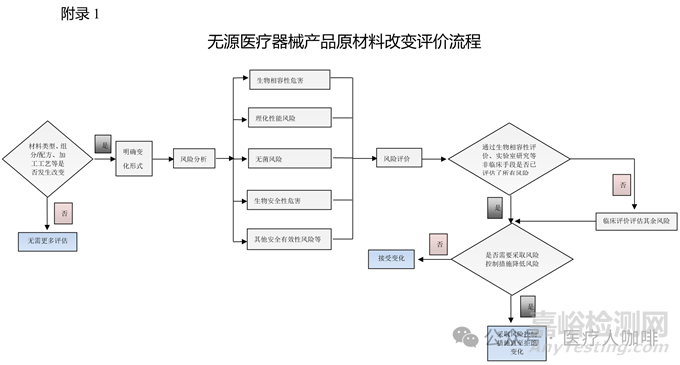
不过,有些读者可能还是不清楚原材料变化,到底该如何分析判定它是实质性还是非实质性呢?这个可以参考国家药监局发布的《无源医疗器械产品原材料变化评价指南》:对因原材料变化而应进行的评价思路进行了阐述并给出了可参考的评价流程(见指南附录1)及变更事项举例(见指南附录2)。

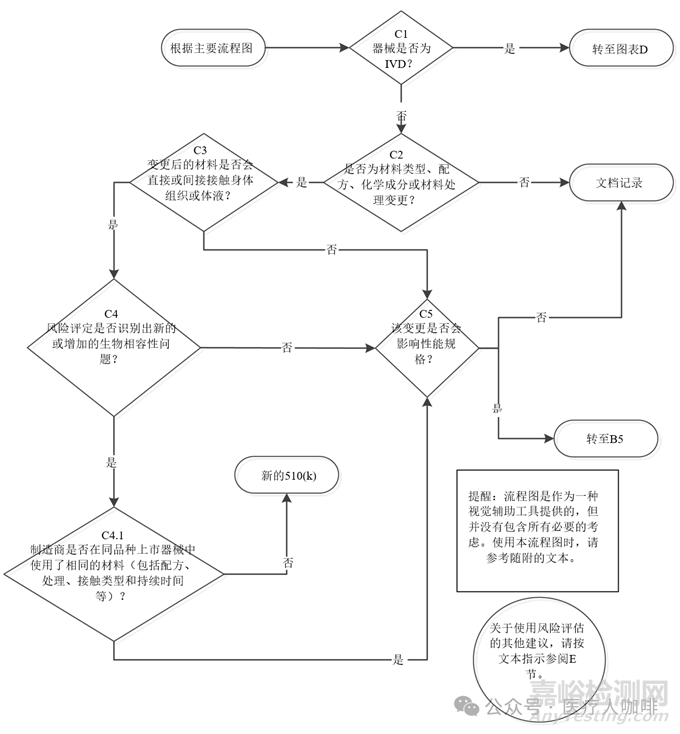
此外,对于在FDA注册的510k器械,也可以参考美国FDA发布的510k变更评审指南的流程图C材料变更进行决策。


来源:Internet


