您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-11-06 08:24
免疫组化(IHC)作为一种重要的实验技术,被广泛应用于病理学研究中。然而,实验过程中常会遇到各种问题,如假阳性、假阴性等问题,严重影响实验结果的准确性和可靠性。本文将结合实际操作经验,详细分析并总结免疫组化实验中可能存在的问题及解决方法,帮助大家提高实验成功率。
一、假阳性或背景高的处理
1. 降低一抗浓度
降低一抗的浓度至既能看到阳性表达又能明显区分阳性区域与周围间质时为止。如无法达到此效果,建议更换一抗。
2. 调整封闭条件
逐步提高封闭条件,从山羊血清到5%BSA+山羊血清,最终至5%脱脂奶。然而,通常调整至5%BSA+山羊血清即可,不建议轻易使用5%脱脂奶。
3. 二抗选择
对于动物标本,选择抗鼠或抗兔的二抗,避免使用通用型二抗,以免种属间抗原抗体反应引起假阳性。
二、假阴性的处理
1. 抗原修复
确保使用正确的抗原修复方法,必要时查阅相关文献。
2. 系统检查
使用任何肿瘤类型的切片进行Ki-67染色,以判断体系及二抗是否存在问题。若Ki-67染色阴性,需检查以下步骤:
二甲苯酒精是否需要更换
PBS缓冲液的pH值是否正常
抗原修复液的使用及修复时间是否正确
3. 标本保存
避免使用保存时间过久的标本。石蜡切片应尽量放置于-20°C避光保存,标本保存超过三年往往影响染色效果。
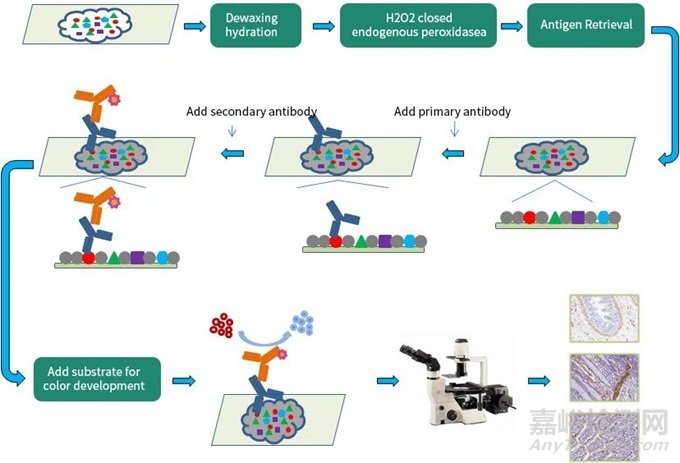
三、设置对照
1. 自身对照
同一张组织切片中,癌和癌旁表达不同的区域可作为自身对照,以确认抗体表达的阳性或阴性为真。
2. 阳性对照
当阳性率过低或无阳性表达时,需做阳性对照,以确认标本阴性为真阴性。
3. 阴性对照
当标本染色阳性率过高时,需做阴性对照,以确认阳性表达并非由非特异性染色引起。
四、阳性对照的制备与选择
1. 购置阳性对照
可从公司购置阳性对照片。
2. 选择合适的阳性对照
根据抗体说明书选择相应的阳性组织,如PD-L1选用人胎盘作为阳标。
3. 试染不同病例
根据文献选择表达率最高的病种,选择5例不同的病例进行试染。
五、实验中的注意事项
1. 抗原修复
微波修复需间隔进行,防止抗原修复液蒸发引起干片。
高压锅内需放置足量的抗原修复液,避免使用蒸馏水或自来水。
2. 一抗的配制
尽量使用抗体稀释液配制一抗工作液,存储不得超过一周,避免使用封闭液或BSA作为抗体稀释液,以防影响一抗效价。
3. DAB显色问题
DAB需现用现配,若非马上使用可暂时避光保存。
显色时需及时观察切片上色情况,区域性黄染出现时即可终止显色。
DAB显色时间较短,一般数秒至1-2分钟,超过5分钟不上色需立即停止显色。
4. 苏木素复染问题
复染前需经蒸馏水清洗以保护苏木素。
根据所用苏木素类型选择适当的分色方法,避免用错分色液。
5. AEC显色问题
AEC显色用于某些特殊肿瘤,如恶性黑色素瘤,显色时间较长,需20-30分钟。
6. 盖玻片处理
盖玻片使用前需过酸处理,时间为数秒,然后置于流水中冲洗干净。
7. 脱水封片
免疫组化染色结束后的切片脱水时间不需很久,每个缸数秒即可。
六、其他实验细节
1. 实验数量
一次实验切片数量不宜过多,特别是初学者,以免时间差距导致结果不稳定。
2. 避免干片
实验过程中避免干片,特别是初学者,宁可浪费一些试剂也不能出现干片情况。
3. 记录与观察
首次实验必须做完整的实验记录,以便查找失败原因,观察时需先低倍后高倍,避免误判。
4. 贴签标明
注意贴签,标明标本号、抗体名称、稀释倍数及日期,以便出现问题时查找原因。
通过以上总结,相信大家可以更好地应对免疫组化实验中的各种问题,提高实验成功率。希望本文能为各位读者提供有价值的参考,助力科学研究顺利进行。

来源:实验老司机


