您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-27 20:57
分析体外诊断试剂临床试验中的质量问题,研究制定其质量保证提升措施。
方法:汇总医院体外诊断试剂临床试验项目自查发现的质量问题并进行分类,利用帕累托图对其进行统计、分类和分析,确定临床试验中存在问题的主要类型,应用鱼骨图进行根因分析,从试验设计、试验实施和数据总结与报告环节制定质量提高措施。
结果:在选取的2013-2019年医院承接体外诊断试剂临床试验的4 235份样本中,共发现质量问题119个,归属10项问题类型,其主要因素为试验记录、试验试剂、方案执行、申报资料、伦理审查及文件和原始记6项,次要因素为试验样本1项,一般因素有试验人员、知情同意和统计分析3项,应用鱼骨图分析影响试验质量原因,针对临床试验的3个主要环节制定17条质量提升措施。
结论:应用帕累托图和鱼骨图分析方法,可梳理出常见的体外诊断试剂临床试验质量问题和原因,制定出体外诊断试剂临床试验质量保证措施,从源头上确保体外诊断试剂临床试验质量。
体外诊断试剂临床试验是指在相应的临床环境中,对体外诊断试剂的临床性能进行的系统性研究。为提高体外诊断试剂临床试验质量,本研究依托试验机构对承接的项目进行自查,应用帕累托图分析和鱼骨图根因分析查找质量问题的根本原因,并从试验设计、试验实施、数据总结与报告3个环节梳理出提高试验质量的管理要点和策略。
1、体外诊断试剂临床试验质量保证研究
1.1 研究资料
选取2013-2019年天津医科大学第二医院承接的25项体外诊断试剂项目,对其临床试验自查情况进行整理,汇总体外诊断试剂临床试验自查中发现的质量问题。
1.2 研究方法
统计试验机构对体外诊断试剂试验项目自查发现问题的数量和问题类型。采用描述性分析方法计算发现问题的构成比及累计构成比,并进行帕累托图分析 [2-3] 。以发现的问题类型为横坐标,问题数量为纵坐标做直方图;以累计构成比为纵坐标做折线图;将直方图和折线图合并,绘制成帕累托图。设定累积构成比≤
80%为主要因素(A类),>80%而≤90%为次要因素(B类),>90%为一般因素(C类)。结合国家食品药品监督管理总局发布的《体外诊断试剂临床试验技术指导原则》 [4] 和《医疗器械临床试验现场检查要点》 [1] 中的体外诊断试剂临床试验现场检查要点,利用鱼骨图对质量问题情况进行根因分析,找出问题并制定提高试验质量措施。
1.3 临床试验质量问题分析
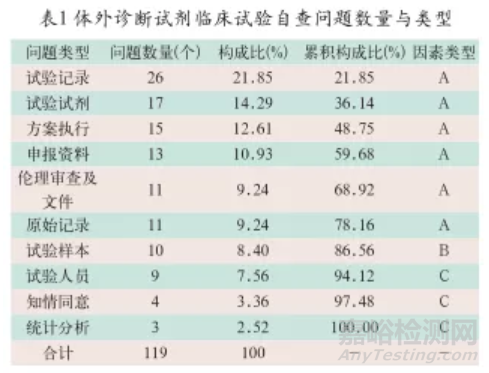
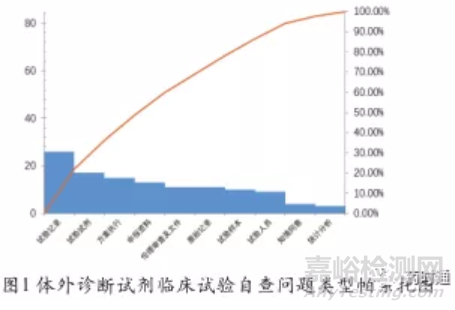
2013-2019年试验机构共开展25项体外诊断试剂临床试验,包含样本4235份,共发现各类质量问题119个。归纳整理发现的质量问题可分为10类,计算累积构成比后,其主要因素有试验记录、试验试剂、方案执行、申报资料、伦理审查及文件和原始记录6项,次要因素为试验样本1项,一般因素有试验人员、知情同意和统计分析3项。体外诊断试剂临床试验自查问题数量与类型见表1,体外诊断试剂临床试验自查问题类型帕累托图见图1。试验自查问题数量与类型见表1,体外诊断试剂临床试验自查问题类型帕累托图见图1。
1.4 临床试验质量问题根因分析
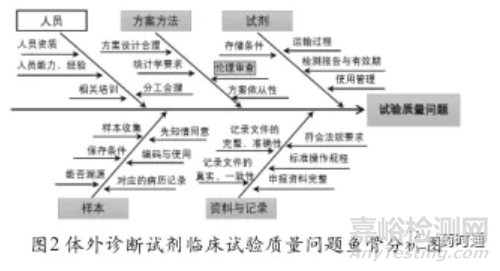
鱼骨分析(Fishbone analysis)又名因果分析,是一种发现问题“根本原因”的分析方法。针对上述自查发现问题的数量与类型,本研究采用鱼骨图进行根因分析,尤其是针对帕累托图中的“主要因素”,共查找出试验质量问题中的试剂、资料与记录、方案方法、样本和人员5方面23个条目的根本原因。体外诊断试剂临床试验质量问题鱼骨分析见图2。
2、体外诊断试剂临床试验质量提升措施
针对帕累托图分析和鱼骨图分析中查找到的试验质量问题的主要因素和原因,本研究分别制定体外诊断试剂临床试验不同环节的质量提升措施。
2.1 试验设计
(1)试验方案。
严格参照《体外诊断试剂临床试验技术指导原则》 [4] 和相应品种的注册技术审查指导原则设计科学、严谨的试验方案。根据诊断试剂的类别、原理与预期用途,选择合适的方法和对照。制定
样本选择的入选和(或)排除标准,需注意拟收集的样本应具有代表性,减少偏倚,明确收集的分布和数量要求,同时兼顾干扰因素的考量。
(2)标准操作规程(standard operating procedure,SOP)与模板。
建立各项工作的SOP和数据记录模板,保证试验实施时有章可依,从源头确保试验记录的完整性。试验涉及的操作内容可参考《医疗器械临床试验现场检查要点》 [1] 中的体外诊断试剂临床试验现场检查要点执行。SOP需根据试验产品特点制定,如即时检验(point-of-care testing,POCT)类试剂应考虑受试者自测情况。
(3)伦理学审核。
客观上不可获得或是该试验对受试者几乎无风险时,可递交伦理委员会免除知情同意的申请,由伦理委员会审查决定是否批准免除 [5] 。并非使用“剩余样本”进行试验或是需要收集受试者医疗资料时,制定知情同意书,获得伦理委员会批准。进行试验前充分告知受试者试验内容,方能开始样本、资料等内容的收集。
(4)统计分析方法。
统计设计和分析实施均应由具有专业资格和经验的人员完成,根据试验方法选择合适的统计分析方法 [6] 。《体外诊断试剂临床试验技术
指导原则》 [4] 中对样本量有相关规定,特殊试验项目需要结合临床或药效学评价计算样本量,年龄及性别段等因素对检测结果有差异时,需要设计亚组分析。
(5)法规要求。
申办者应选择有资质且具有与试验产品相适应的专业技术人员、仪器、场地和样本的试验机构。开始试验前申办者应当向所在地省、自治区及直辖市药品监督管理部门备案,符合《中华人民共和国人类遗传资源管理条例》 [7] 的需向科技部进行相应申报。
2.2 试验实施
(1)试验开始前需召集相关人员进行试验方案和操作的专门培训。
试验的主要研究者和项目核心成员需要经过临床试验质量管理规范(good clinicalpractice,GCP)培训。主要研究者根据研究团队中成
员的资质和能力经验进行分工。如需要根据检查结果选择合适受试者和(或)样本,则样本收集、编盲和检测这3个环节应由不同的技术人员完成,以确保试验处于盲态;若不符合免除知情同意过程情况时,则需安排获取知情同意和评价疗效的医生和采血护士参与培训和分工,以确保他们能配合好试验的开展。
(2)根据已设定入选和(或)排除标准收集样本。
检查标本质量和信息完整程度,已纳入的样本不得随意剔除。为保证选择样本的充分分布,若方案中无规定则不应收集相同受试者不同时间采集的样本入组。
(3)获得知情同意一定要在受试者进入试验和采集样本前。
由于参与诊断试剂试验的检查是免费的,有时无法录入到医院的医院信息系统(hospitalinformation system,HIS)和(或)检验信息系统(laboratory information system,LIS),因此,采样时间无法在检查报告及医院的信息系统中查询,所以应建立事先设计好的采样时间表,由护士或其他采样者填写。
(4)收集药效学和金标准的原始病历。
药效学样本需要与受试者核对使用药物,记录合并用药,确认是
否符合入选和(或)排除标准,避免误将不符合方案规定的样本收集进入试验。药效学评估应由相应科室的研究医生完成,且在完成评估前,研究医生不能获知诊断试剂检测的结果,以免形成偏倚。
(5)收集纳入的样本应按照规定的温度条件进行保存。
需要明确温度范围的上限和下限,使用的温度记录仪应为合格且经校验,完成收集后依据制定好的SOP进行编盲。
(6)体外诊断试剂的运输条件应符合说明书要求和产品特定。
低温产品需要冷链运输,同时监测并记录过程温度 [8] ;配合使用的检测设备仪器运输到试验机构后,应由申办厂家的工程师安装和调试,并对试验中负责仪器操作的研究人员进行培训,建立使用记录。
(7)按照试验方案和试剂说明书要求进行样本检测。
每批样本检测时应同时完成质量控制实验和线性范围实验,出现结果不一致时,应按照方案预先规定进行第三方复核。
(8)数据保存。
开展临床试验的试剂有时需要用到申办厂家所提供的检测设备,这类设备不能联接到LIS中,或是由于试验结果不能上传到LIS中。因此,
为了日后检查的溯源要求,应及时导出数据或是采用截屏、拍照的方式保存试验结果,然后将数据以只读方式刻盘保存。
2. 3试验数据总结与报告
CAR-T 细胞
(1)试验数据核对。
依照试验方案和统计分析计划实施数据分析,再次核对入选和(或)排除标准是否符合,不符合标准的样本不应纳入到统计分析,同时符
合标准的样本不能无故剔除。
(2)临床总结报告。
完成统计分析后,由研究者根据统计分析结论给出临床结论,完成临床总结报告。总结报告的内容务必和试验过程中完全一致,如试剂批号、实际收集并检测的样本数量以及第三方复核检测等情况。
(3)试验资料整理。
分门别类地整理好试验相关的各类文件,包括研究者文件夹、原始病历、知情同意书(如适用)、检测报告等原始数据文件以及试验过程文件等。
(4)受试者隐私保护。
为保护受试者隐私,应将包括受试者姓名等可识别信息的文件仅保存在研究中心,申办者保存和递交审批的文件应用编号代替隐私信息。
3、讨论
随着检测技术的不断变革,体外诊断试剂在临床实践中的作用愈来愈大,为诊断和治疗提供了重要依据 [9] 。而以往申办者和研究者对临床试验的重视程度不高,观念上认为该类临床试验仅为仪器检测,忽视试验设计、知情同意、样本和(或)试剂规范化管理及统计分析等重要内容,试验质量良莠不齐。随着国家对样本及体外诊断试剂管理要求的不断提高,对试验过程和试验人员的要求以及试验结果的真实性、科学性和可靠性均进行了严格要求,近期发生的新型冠状病毒疫情也提示体外诊断试剂对临床诊疗的影响越发明显,临床上急需诊断精准度高的产品 [10-11] 。帕累托图是将出现的质量问题和质量改进项目按照重要程度依次排列的一种图表,有助于对质量分析进行优化和改进 [12-13] 。
本研究从人员、案例方法、试剂、样本以及资料与记录方面,对天津医科大学第二医院2013-2019年间开展的体外诊断试剂临床试验中发现的问题进行整理分析,查找到人员资质以及能力经验等原因。本研究分析结果显示,试验记录、试验试剂、方案执行、申报资料以及伦理审查是位列前五位的主要问题。鱼骨图是一种发现问题“根本原因”的方法,可全面地分析与探讨问题,找出问题的真因,为解决并改善所存在的问题提供基础。
4、结论
本研究根据试验机构的项目质量检查自查,通过鱼骨图分析和帕累托图对存在问题的类型和数量进行整理分析,研究制定的质量提升措施,能确保研究者从开始就做好、做对临床试验,从源头上提高体外诊断试剂临床试验质量。由于该方法进行质量问题评估未考量问题的严重程度,在日后的研究中会考虑引入问题的权重,使得质量问题评估更为精准。

来源:Internet


