您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-11 10:46
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
微芯降糖新药即将获批上市。微芯生物1类新药「西格列他钠」审评状态已变更为「在审批」,预计即将获批,成为继西达本胺之后微芯生物获批上市的第二款产品。西格列他钠(商品名为双洛平)是一款PPAR全激活剂,属于全新作用机制的胰岛素增敏剂,用于治疗2型糖尿病。去年12月,微芯生物已将双洛平®在中国19个省份区域的推广权独家授予海正药业。
国内药讯
1.腾盛博药新冠鸡尾酒在美报EUA。腾盛博药宣布向FDA 提交其新冠中和抗体组合疗法BRII-196/BRII-198紧急使用授权(EUA)申请。在一项Ⅲ期临床ACTIV-2中,联合疗法与安慰剂相比使COVID-19门诊患者的住院及死亡的复合终点降低78%(P<0.00001);在症状出现后5天内或6-10天内接受BRII-196/BRII-198治疗的患者中,均只有2%(vs11%)的患者进展为住院或死亡。此外,联合疗法对Alpha、Beta、Gamma、Epsilon、Delta、Lambda以及Mu等病毒变异株均保持中和活性。
2.恒瑞两款1类新药获批临床。恒瑞及其子公司瑞石生物2款1类新药(HRS7415片和SHR0302片)临床试验申请获国家药监局默示许可,其中HRS7415拟开发用于治疗晚期恶性肿瘤,此次为首次获批临床;SHR0302是恒瑞中美双报的一款小分子JAK1抑制剂,目前在国内开展了针对类风湿性关节炎、溃疡性结肠炎、克罗恩病等多项临床。此次获批的临床适应症为溃疡性结肠炎。
3.创胜PD-L1/TGF-β双抗国内报IND。创胜集团迈博斯生物创新PD-L1/TGF-β双抗TST005注射液的临床试验申请获CDE受理,拟用于实体瘤的治疗。在多个同源小鼠肿瘤模型中,TST005可显著增加CD8阳性T细胞向PD-L1表达的肿瘤中的浸润并在高表达TGF-β的同源小鼠肿瘤模型中显示出剂量依赖性的肿瘤生长抑制。今年7月,TST005已在美国开展的I期临床完成首例患者给药。
4.中生制药TCR1672在美报IND。中国生物制药集团创新药TCR1672的临床试验申请获FDA受理。TCR1672是新一代高选择性P2X3受体拮抗剂,能够通过阻断ATP启动P2X3受体所产生的钙离子内流,从而起到特异性抑制神经元超敏化的效果,可适用于难治性慢性咳嗽(RCC)与子宫内膜异位症等复杂性内脏痛患者。在全球范围内,目前尚未有P2X3抑制剂获批。
5.江苏晟科治疗AML新药报IND。晟科药业1类新药ETH-155008片的临床试验申请获CDE受理,拟针对急性髓性白血病(AML)开展相关临床试验。ETH-155008是一款双重抑制剂,能够靶向作用于Fms样酪氨酸激酶3与CD4/6,已在临床前研究中显示出显著的抗AML作用。目前已获批上市用于治疗AML的FLT3抑制剂有midostaurin、gilteritinib与quizartinib,ETH-155008的开发有望为AML患者带来更多的临床用药选择。
6.上海医药引入新一代P-CAB。上海医药与贵州生诺就后者的抑酸新药X842签订合作协议。X842是新一代钾离子竞争性酸阻断剂(P-CAB)口服药物,正在III期临床中评估治疗反流性食管炎的潜力。根据协议,上海医药将获得X842项目原料药及制剂在中国区域的独家委托生产和所有适应症的工业销售权。此项交易金额不超过6.9亿元人民币。
国际药讯
1.FDA批准首个口服补体C5a受体抑制剂。ChemoCentryx公司口服补体5a(C5a)受体抑制剂Tavneos(avacopan)获FDA批准上市,与标准疗法联用,辅助治疗两种主要的抗中性粒细胞胞浆自身抗体相关血管炎:显微镜下多血管炎(MPA)和肉芽肿伴多血管炎(GPA)。在一项Ⅲ期临床中,avacopan治疗组第52周时的缓解率优于标准治疗(65.7%vs54.9%)。这也是FDA批准的首款口服补体C5a受体抑制剂。
2.FDA批准首个胸腺组织再生疗法。FDA批准Enzyvant公司再生疗法Rethymic上市,用于治疗小儿先天性无胸腺症。Rethymic由从供体获取的同种异体胸腺组织构成,在经过处理和培养后,移植到患儿体内,帮助重建免疫力。在临床研究中,Rethymic改善先天性无胸腺症患儿(年龄为1个月到16岁)的生存,大部分接受治疗的患儿生存至少两年。Rethymic也是FDA批准的首款胸腺组织产品。
3.武田TAK-620有望获FDA批准。FDA抗菌药物咨询委员会(AMDAC)全票支持武田UL97激酶抑制剂maribavir(TAK-620)上市,用于治疗接受造血干细胞移植(HSCT)或器官移植(SOT)的难治性巨细胞病毒(CMV)感染患者。与常规抗病毒治疗相比,TAK-620具有更高的安全性。FDA曾授予maribavir突破性疗法认定和优先审评资格。如果获批,maribavir将成为首款用于这类患者的获批疗法。
4.罗氏治疗AD抗体获突破性疗法认定。罗氏旗下基因泰克公司皮下注射抗β淀粉样蛋白抗体gantenerumab获FDA授予突破性疗法认定,用于治疗阿尔茨海默病(AD)。gantenerumab已在多项临床中显示出显著降低AD患者大脑中的淀粉样蛋白沉积的潜力,目前正在两项Ⅲ期临床中接受检验。这两项试验预计将在2022年下半年完成。
5.KAAG1-ADC创新疗法上临床。ADC制药公司KAAG1-ADC新药ADCT-901在Ⅰ期临床中首例患者给药。该项试验将评估ADCT-901用于治疗某些晚期实体瘤患者(包括经治卵巢癌和三阴性乳腺癌)的安全性、耐受性、药代动力学和抗肿瘤活性。KAAG1是一种在大部分卵巢癌和三阴性乳腺癌中高度表达的肿瘤相关抗原。ADCT-901通过释放的吡咯苯二氮卓(PBD)与不同的DNA链交联,以阻碍DNA的复制和细胞分裂。
6.Mirati与赛诺菲达成临床合作。Mirati公司在研KRAS G12C抑制剂adagrasib拟联合赛诺菲SHP2抑制剂SAR442720(RMC-4630)开展一项Ⅰ/Ⅱ期剂量递增和扩展试验,在既往接受过治疗的KRAS G12C突变非小细胞肺癌(NSCLC)患者中评估联合治疗的效果。KRAS G12C抑制和SHP2抑制具有互补的作用机制,并已在临床前模型中表现出协同的抗肿瘤活性。今年6月,Adagrasib已获FDA授予突破性疗法认定,用于治疗携带KRAS G12C突变的NSCLC经治患者。
7.强生联手Xencor开发CD3/20双抗。强生宣布与Xencor公司达成合作协议,双方将共同开发CD3/CD20双抗Plamotamab,以丰富其B细胞的产品管线。Plamotamab由Xencor开发,其构建方式为异源二聚体方式,一侧为Fab,一侧为scFv,具有良好的安全性,尚未发现有严重的CRS不良反应。根据协议,强生将向Xencor公司支付1亿美元的预付款,2500万美元的股权投资,以及11.88亿美元的里程碑金额。
医药热点
1.广安门医院拟在大兴新建三甲中医院。北京市大兴区政府与中国中医科学院广安门医院签订战略合作框架协议,拟在大兴区规划新建三级甲等中医医院。项目建成投用后,广安门医院将选派优质的管理、医疗团队运营管理。大兴区政府将协调区内的相关资源,与广安门医院强强联合,共同推进肿瘤相关的中医基础探究、中药创新研发、制剂成果转化。
2.江苏推广家庭药师居家药学服务。江苏省发布《江苏省家庭药师居家药学服务实施方案》,提出将家庭药师纳入家庭医生签约服务团队,规范家庭药师居家药学服务。家庭药师开展居家药学服务的重点是独立或配合专科医生、全科医生等开展药物治疗管理。主要服务内容是提供用药建档、药物咨询、药物治疗管理、重点人群用药监护、家庭药箱管理、合理用药科普、宣传国家药物政策等丰富多样的个性化用药指导服务。
3.“德尔塔”或是新冠最后变异株。美国国家科学院院士库宁(Eugene Koonin)在出席新西伯利亚科尔佐沃科学城举行的生物技术论坛OpenBio时表示,德尔塔是一个稳定的新冠毒株,在众多人群接种疫苗的情况下,该病毒很难突破已形成的免疫防御,很可能是该病毒的最后一个变异株。
评审动态
1. CDE新药受理情况(10月09日)
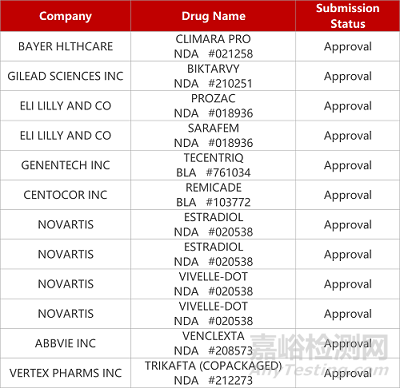
2. FDA新药获批情况(北美10月07日)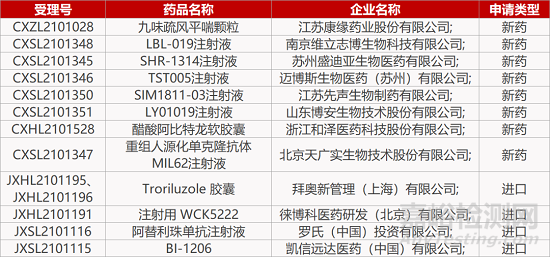

来源:药研发


