您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-12-13 11:48
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.特瑞普利单抗新适应症报上市。NMPA受理君实生物自主研发的PD-1特瑞普利单抗第六项上市申请,联合标准一线化疗用于未经治疗、驱动基因阴性的晚期非小细胞肺癌(NSCLC)。在一项Ⅲ期临床CHOICE-01(NCT03856411)中,与单纯化疗方案相比,特瑞普利单抗联合化疗一线治疗晚期NSCLC可显著延长患者的PFS,降低疾病进展风险,并在总生存期(OS)方面观察到了获益趋势。
2.替雷利珠单抗鼻咽癌Ⅲ期临床积极。百济神州PD-1替雷利珠单抗联合化疗一线治疗复发/转移性鼻咽癌的Ⅲ期临床达到主要终点。中位随访10个月时,与安慰剂联用化疗相比,该组合疗法显著延长患者的无进展生存期(中位PFS:9.2个月vs7.4个月;HR=0.52,95% CI:0.38,0.73,p<0.0001)。第6、9和12个月时无进展生存率为66.1%vs53.0%、51.0%vs21.6%和35.7%vs12.2%。NMPA已受理该新药上述适应症的sBLA申请。
3.先声药业2款抗肿瘤新药获批临床。先声药业两款1类新药SIM1811-03和paxalisib获国家药监局临床试验默示许可。SIM1811-03是一款TNFR2抗体,拟用于治疗晚期实体瘤和皮肤T细胞淋巴瘤。paxalisib是该公司从Kazia公司引进的小分子PI3K/mTOR抑制剂,拟用于新诊断和复发的胶质母细胞瘤(GBM)。FDA此前已授予paxalisib治疗GBM的孤儿药资格和快速通道资格,以及治疗弥漫性内生型桥脑胶质瘤罕见儿童疾病认定和孤儿药资格。
4.礼新医药CCR8单抗在美报IND。礼新医药宣布已向FDA成功申报自主研发新药LM-108的临床试验。注射用LM-108是一款CCR8靶向单抗药物,能够通过抗体依赖的细胞介导的细胞毒性作用(ADCC)特异性清除肿瘤浸润Treg来调节肿瘤微环境,同时不影响外周Treg。该产品有望为晚期肿瘤患者带来新的免疫治疗选择,同时也能使部分对现有免疫疗法耐药或不适用的患者获益。
5.锐格医药和礼来达成战略合作。锐格医药与礼来将利用前者AI辅助新药研发平台CARD,共同开发针对代谢性疾病领域的创新候选疗法。根据协议,锐格医药将获得总计5000万美元的预付款,最高15亿美元的潜在临床前、临床开发和商业化里程碑付款,以及产品的全球销售分成。礼来将负责候选品种除大中华区(包括中国大陆、香港、澳门及台湾)外的临床开发、生产及商业化权益。
国际药讯
1.辉瑞/BioNTech新冠疫苗获批增强针EUA。FDA扩展辉瑞和BioNTech开发的mRNA新冠疫苗增强针的紧急使用范围,允许16岁以上人群,在完成两针疫苗接种至少6个月之后,接受增强针的接种。在一项Ⅲ期临床中,与安慰剂相比,增强针的相对保护效力达到95.6%,而且在所有年龄组中保护效力一致。不良事件特征与疫苗的其他临床试验安全性数据基本一致。
2.罕见病药物Aspaveli获英国NICE支持。英国国家健康与护理卓越研究所(NICE)推荐批准Sobi公司阵发性夜间血红蛋白尿(PNH)药物Aspaveli(pegcetacoplan)上市,用于接受C5抑制剂(如阿斯利康的Ultomiris)治疗至少三个月后出现贫血的PNH患者。pegcetacoplan是一款C3抑制剂,已获FDA批准用于治疗PNH成人患者,商品名为Empaveli。据悉,该新药计划明年向FDA提交新适应症申请,用于治疗年龄相关性黄斑变性继发性地图样萎缩。
3.血友病B基因疗法Ⅲ期临床积极。CSL Behring与uniQure联合开发的AAV5基因疗法etranacogene dezaparvovec治疗中重度至重度血友病B患者的关键性Ⅲ期临床结果积极。与凝血因子IX(Factor IX,FIX)预防性治疗相比,该疗法第18个月时达到FIX稳定表达后评估的ABR(年出血率)为1.51(vs4.19),达到非劣效性标准,而且在降低ABR方面具有统计学优效性。该疗法此前已获FDA授予突破性疗法认定,CSL Behring计划明年上半年向FDA递交监管申请。
4.罗氏TIGIT单抗肺癌Ⅱ期临床积极。罗氏旗下基因泰克TIGIT抗体tiragolumab联合PD-L1抑制剂阿替利珠单抗(atezolizumab),在一线治疗PD-L1阳性转移性非小细胞肺癌的Ⅱ期临床获积极结果。中位随访2.5年时,联合疗法与atezolizumab单药相比,在ITT人群中使疾病进展或死亡的风险降低38%(中位PFS:5.6个月vs3.9个月;HR=0.62,95% CI:0.42–0.91)并提高OS(中位OS:23.2个月vs14.5个月;HR=0.69,95% CI:0.44–1.07);在TPS≥50%患者中,同样提高患者PFS(中位PFS:16.6个月和4.1个月;HR=0.29,95% CI:0.15–0.53)。
5.Moderna四价流感mRNA疫苗早期临床积极。Moderna公司四价季节性流感疫苗mRNA-1010在Ⅰ期临床中取得积极中期数据。在年轻成人中,与基线相比,针对H1N1、H3N2、Yamagata和Victoria的抗体几何平均滴度(GMT)分别提高大约10倍、8倍、3倍和2倍,但未观察到明显的剂量依赖性;在老年人组中,与基线相比,抗体GMT的提升分别为6倍、6倍、3倍和2倍。临床中未观察到严重安全性信号。
6.乙肝RNAi疗法上Ⅱ期临床。Vir Biotechnology公司旨在功能性治愈乙肝的靶向HBV的X基因的RNAi疗法VIR-2218,在一项联合用药治疗慢性乙肝病毒(HBV)感染的Ⅱ期临床首例患者给药。该项临床旨在评估VIR-2218与吉利德TLR-8激动剂selgantolimod的联合方案,和PD-1抗体nivolumab联用,治疗初治或经治乙肝患者的安全性、耐受性和疗效。主要终点为达到功能性治愈(定义为随访24周时,血清中乙肝表面抗原消失,和乙肝病毒DNA<20 IU/mL)的患者比例。
医药热点
1.四川壮大康复医疗专业队伍。四川省卫健委等9个部门联合印发《四川省加快发展康复医疗服务工作实施方案》。《实施方案》要求,力争到2022年,逐步建立一支数量合理、素质优良的康复医疗专业队伍,每10万人口康复医师达到6人、康复治疗师达到10人;到2025年,每10万人口康复医师达到8人、康复治疗师达到12人。
2.新疆“两病”患者门诊用药945万人次。新疆今年持续深化“两病”门诊用药保障和健康管理专项行动等活动,统筹做好“两病”门诊用药保障与普通门诊统筹、门诊特殊慢性病保障等政策归口衔接,分类实施保障。截至今年10月底,新疆945.86万人次享受“两病”门诊用药待遇,“两病”患者门诊累计发生费用8.45亿元,较2020年年底增加4.48亿元。其中,医保基金累计支付5.01亿元,较2020年年底增加了2.65亿元。
3.川渝地区首个晕厥门诊正式开诊。四川省人民医院设立的专门的晕厥门诊于12月10日正式开诊,旨在为患者提供便捷而专业的一站式晕厥诊疗服务。晕厥门诊将发挥“前哨”作用,医生将通过详细病史采集和记录,为患者提供专业、准确的二级分诊,判断患者应该到什么科室就诊。这也是川渝地区开设的首个晕厥门诊。
4.殷敏将出任百济神州CBO。百济神州宣布,殷敏将于2022年1月正式加入百济神州, 担任大中华区首席商务官,直接向总裁吴晓滨汇报。同时将成为百济神州中国领导团队和全球执行委员会的成员。阿斯利康此前宣布,阿斯利康中国肿瘤事业部总经理殷敏,阿斯利康中国副总裁、零售事业部负责人王东将于12月31日正式离职,肿瘤事业部暂由阿斯利康中国总裁王磊领导。
评审动态
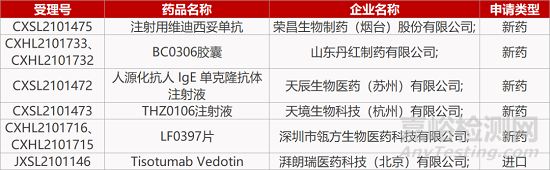
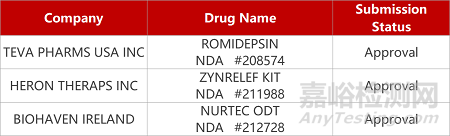

来源:药研发


