您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-08 10:55
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
南京宁丹FIC脑卒中新药报IND。南京宁丹新药公司1类化药Y-3注射液的临床试验申请获CDE受理。Y-3是一款PSD-95/nNOS解偶联和GABAA受体α2亚基选择性激动剂,能够同时干预缺血性卒中后的神经元兴奋性损伤及突触可塑性改变;并且由于其靶点特异性高,可减少NMDA及GABAA受体相关毒性。Y-3拟开发用于脑卒中发病后急性期使用,能够兼顾改善急性缺血损伤和降低抑郁发生率或减轻严重程度。
国内药讯
1.歌礼PD-L1抑制剂获批临床。歌礼自主研发的口服PD-L1小分子抑制剂ASC61获FDA临床许可,即将在美国开展用于晚期实体瘤患者中剂量递增的Ⅰ期临床试验。首例患者预计将于2022年上半年完成给药。在临床前研究中,ASC61单药在人源化小鼠模型等多种动物模型中表现出显著的抗肿瘤疗效,并具有良好的安全性和药代动力学特征。
2.德琪CD73抑制剂获批临床。澳大利亚Bellberry人类研究伦理委员会(HREC)批准德琪医药ATG-037用于治疗局部晚期或转移性实体瘤患者的I期临床试验STAMINA。ATG-037是一款口服CD73小分子抑制剂。CD73可产生在肿瘤微环境中具有高度免疫抑制作用的腺苷。在临床前研究中,ATG-037单药以及与免疫检查点抑制剂(CPI)联合或化疗药物的联用显示了良好的抗肿瘤活性。
3.爱姆斯坦干细胞疗法报IND。爱姆斯坦生物治疗用生物制品1类新药IMS001注射液的临床试验申请获CDE受理。IMS001是一种来自人胚胎干细胞系的异体间充质干细胞(MSC)产品。爱姆斯坦计划开展一项剂量递增、开放标签的临床研究,针对既往疾病修正治疗(DMTs)失败的复发-缓解型、继发性或原发性进展型多发性硬化症患者,评估单剂量静脉注射IMS001的安全性、耐受性和探索性疗效。
4.信达PD1单抗2021年Q4销售约9亿。信达生物日前发布公告,宣布达伯舒(信迪利单抗)2021年Q4销售收入为约9亿元人民币,产品销售量保持逐季增长的良好态势。信迪利单抗是信达生物与礼来联合开发的一款PD1单抗,目前已获批一线非鳞非小细胞肺癌、一线鳞状非小细胞肺癌、一线肝癌及至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤四项适应症,并均被纳入国家医保目录。
5.君实发布2021年业绩预告。君实生物发布2021年度业绩预告。2021年实现营收40.14亿元左右,同比增长151.68%;净利润-7.36亿元左右,与上年同期相比亏损减少55.89%左右;研发费用20.75亿元左右,同比增长16.70%。君实生物营收大幅提升主要来源于核心产品PD-1特瑞普利单抗注射液(商品名:拓益®)国内市场商业化带来的销售收入、技术许可收入的大幅增长以及特许权收入的新增。
国际药讯
1.赛诺菲CAD孤儿药获批上市。FDA批准赛诺菲补体C1s抑制剂Enjaymo(sutimlimab-jome)上市,用于治疗冷凝集素病(CAD)患者。这也是FDA批准用于CAD的首款疗法。在关键性Ⅲ期临床中,Enjaymo使54%的患者达到主要复合终点,患者第23、25和26周时的血红蛋白(Hgb)水平较基线增加至少2 g/dL,且从第5周到第26周无需输血。此前它曾获FDA授予的突破性疗法认定、孤儿药资格和优先审评资格。
2.重症肌无力FIC新药Ⅲ期临床成功。优时比新型大环肽类C5补体抑制剂zilucoplan治疗全身性重症肌无力(gMG)的Ⅲ期临床达到主要终点和所有关键次要终点。与安慰剂组相比,zilucoplan组第12周时患者重症肌无力-日常生活活动能力量表(MG-ADL)总分较基线显著改善;QMG、MGC和MG-QoL15r的评分较基线也显著改善;而且zilucoplan具有良好的安全性与耐受性。优时比计划在美国、欧盟和日本提交zilucoplan的监管申请。
3.CD30-ADC淋巴瘤Ⅲ期临床积极。Seagen公司与武田联合开发的CD30-ADC药物Adcetris(brentuximab vedotin)用于一线治疗晚期经典型霍奇金淋巴瘤(cHL)的Ⅲ期临床结果积极。中位随访时间大约为6年时,与化疗组相比,Adcetris联合化疗使患者死亡风险降低41%(HR 0.59;[95% CI:0.396-0.879]),显著改善患者的总生存期(p=0.009);而且安全性特征与既往研究一致。该药此前已获批用于治疗某些类型的复发/难治性霍奇金淋巴瘤。
4.肥胖症FIC新药启动3项Ⅱ期临床。Aardvark Therapeutics公司开发的潜在“first-in-class”小分子苦味受体(TAS2R)泛激动剂ARD-101即将启动三项Ⅱ期临床试验,分别在普通肥胖症、难治性减肥手术体重增加的患者以及Prader-Willi综合征(PWS)患者中检验降低食欲和减重的有效性和安全性。ARD-101通过口服并在胃部释放,能够与肠道细胞表面TAS2R结合以增加GLP-1等内源性肠肽激素的表达,从而产生全身性代谢调节作用。
5.渤健与罗氏合作开发CD20/3双抗。Biogen宣布将向罗氏旗下基因泰克支付3000万美元选择权行权费用,与基因泰克合作共同推进mosunetuzumab的开发和商业化 。Mosunetuzumab是一款CD20xCD3双抗,拟开发用于治疗B细胞非霍奇金淋巴瘤,包括滤泡性淋巴瘤1型和弥漫性大B细胞淋巴瘤。2020年6月,FDA已授予mosunetuzumab治疗复发或难治性滤泡性淋巴癌(FL)的突破性疗法资格。在R/R FL患者中,该药实现18个月以上的完全缓解,完全缓解率为60.0%。
6.CAR-T研发公司Arcellx拟登陆纳斯达克。Arcellx公司宣布将登陆纳斯达克并IPO募集资金约1.24亿美元。Arcellx的主打候选药物CART-ddBCMA是一款靶向BCMA的下一代CAR-T疗法,已在治疗复发/难治性多发性骨髓瘤的Ⅰ期临床中达到100%的总缓解率(ORR)。FDA已授予其快速通道资格、先进再生医学疗法认定和孤儿药资格。IPO资金将用于推动CART-ddBCMA进入关键性临床试验,以及推动其可控CAR-T在研疗法进入临床开发阶段。
7.杨森10亿美元布局创新ADC。强生旗下杨森与Mersana公司将利用后者专有的ADC开发技术平台Dolasynthen,针对杨森提供的三个靶点的专有抗体,合作开发创新ADC候选疗法。Dolasynthen能够在抗体上的特定位置偶联产生功能的载荷,并且精确控制药物抗体比。根据协议,两家公司将合作进行临床前开发,杨森负责临床开发和商业化。Mersana公司将获得4000万美元的前期付款,和超过10亿美元的潜在里程碑付款。
医药热点
1.新冠重症死者出现AD特征。美国哥伦比亚大学的研究团队发表在临床神经学领域顶级期刊《Alzheimer's & Dementia》(IF=21.566)上的一项小型最新研究显示,新冠肺炎重症死亡病例的脑部出现阿尔兹海默症(AD)的典型特征:脑细胞中积累了异常数量tau蛋白和β-淀粉样蛋白斑块。研究通讯作者Andrew Marks博士表示,如果病情较轻的新冠患者大脑也出现类似变化,这或许有助于解释与长期新冠症状有关的“脑雾”。
2.广西百色全员居家隔离。2月6日0—24时,国内新增新冠确诊病例79例。其中境外输入病例34例(广东21例,上海8例,北京1例,浙江1例,福建1例,河南1例,广西1例);本土病例45例(广西37例,均在百色市;广东4例,其中深圳市3例、广州市1例;北京3例,天津1例)。无新增死亡病例。新增疑似病例1例,为境外输入病例(在上海)。7日0时起,广西百色市全员居家隔离。
3.山西推广夜间中医门诊。山西省卫健委印发《关于推广开设夜间中医门诊的通知》。《通知》要求,省、市级中医医疗机构于3月底前全部开设夜间中医门诊,提供中医诊疗及养生保健、药膳食疗等服务;鼓励有条件的县级中医医疗机构开展夜间中医门诊服务。各中医医疗机构要建立激励机制,完善绩效考核,提高夜间中医门诊医务人员待遇。
评审动态
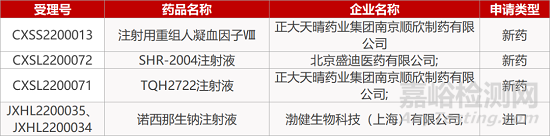
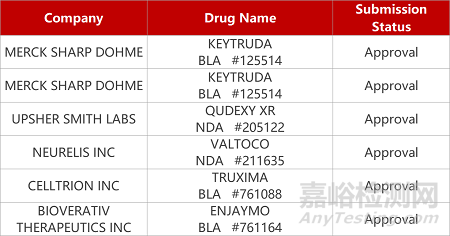

来源:药研发


