您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-01 11:43
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.高氨血症新药在华报产。Recordati Rare Diseases公司在中国申报的5.1类新药卡谷氨酸分散片(Carbaglu)的上市申请获CDE受理。卡谷氨酸是一个合成的N-乙酰谷氨酸(NAG)结构类似物,是肝脏线粒体中必不可少的氨甲酰磷酸合成酶-1(CPS-1)的重要变构激活剂。在美国,Carbaglu已获FDA批准用于辅助治疗N-乙酰谷氨酸合成酶(NAGS)缺乏症引起的高氨血症,以及用于辅助治疗因丙酸血症(PA)或甲基丙二酸血症(MMA)引起的急性高氨血症。
2.康宁杰瑞PD-L1/CTLA-4双抗III期临床成功。康宁杰瑞PD-L1/CTLA-4双抗KN046联合含铂化疗治疗晚期不可切除或转移性鳞状非小细胞肺癌的首个III期临床(ENREACH-LUNG-01)中期数据积极。与安慰剂联合化疗相比,KN046联合化疗显著延长无进展生存期(PFS),达到优效性标准。安全性特征与已知研究结果一致。研究结果将在学术会议上公布。康宁杰瑞表示将按计划递交新药上市申请。
3.基石ROR1 ADC上国际I期临床。基石药业从LegoChem Biosciences引进的ROR1 ADC药物CS5001在美国完成国际I期临床试验首例患者入组。基石药业目前正在全面推进CS5001的全球同步临床开发,已在美国和澳洲获批启动国际多中心的I期临床,在中国的临床试验申请也已获得受理。这项国际临床旨在评估CS5001在晚期B细胞淋巴瘤和实体瘤中的安全性、耐受性、药代动力学和初步抗肿瘤活性。
4.杭州百凯TROP-2-ADC在美获批临床。百凯生物宣布其自主开发的靶向TROP-2的创新抗体偶联药物(ADC)BIO-106获FDA批准,日前已在美国开展Ⅰ期临床试验。TROP-2全称为人滋养细胞表面抗原,在包括乳腺癌、肺癌、胃癌、结直肠癌等多种实体肿瘤中高表达。BIO-106是一款基于TROP-2的病理生理表达特性进行特异性设计的新型ADC,具有更佳的治疗窗口和安全性。此次为百凯医药首个美国IND获批。
5.君境生物四代EGFR抑制剂报IND。君境生物1类新药WJ13404片的临床申请获CDE受理。WJ13404是第四代EGFR抑制剂,临床前数据显示该药物对Del19/T790M/C797S和L858R/ T790M/C797S在内的,对第三代EGFR抑制剂不敏感的获得性EGFR变异有很好的抑制活性,同时对野生型EGFR具有高度选择性。去年11月,再鼎医药曾以0.25亿美元的预付款和5.9亿美元的潜在里程碑付款及特许权使用费从Blueprint引进两款四代EGFR抑制剂(BLU-701和BLU-945)。
国际药讯
1.渤健提交Aβ单抗Ⅳ期临床方案。渤健宣布已向FDA提交其Aβ单抗Aduhelm的Ⅳ期ENVISION试验最终方案。该项研究将招募约1500例早期阿尔茨海默病患者并确认其β淀粉样蛋白病理学,评估100mg/mL剂量Aduhelm注射液用于早期阿尔茨海默病的治疗效果。试验主要终点是在Aduhelm治疗开始后18个月通过临床痴呆评定量表(CDR-SB)进行测量,此外还将涵盖一项长期扩展研究,收集患者48个月的长期数据进行分析。
2.创新FGFR抑制剂获优先审评资格。FDA受理日本大鹏旗下Taiho Oncology不可逆FGFR口服抑制剂futibatinib(TAS-120)的新药申请(NDA),用于治疗FGFR2基因重排或融合的局部晚期或转移性胆管癌经治患者。FDA同时授予其优先审评资格,预计9月30日前做出回复。在一项关键Ⅱb期临床中,futibatinib的客观缓解率达到41.7%。此前,FDA已授予futibatinib用于治疗胆管癌的突破性疗法认定和孤儿药资格。
3.3CL蛋白酶抑制剂抗新冠获快速通道资格。FDA授予Enanta公司冠状病毒3CL蛋白酶抑制剂EDP-235快速通道资格。临床前研究显示,EDP-235可阻断SARS-CoV-2在多细胞模型中的复制;而且口服生物利用度好,无需利托那韦的促进,预期每天给药1次。目前,EDP-235正在开展首项人体试验,在健康志愿者中评价口服EDP-235单剂量递增(SAD)和多剂量递增(MAD)与安慰剂相比的安全性、耐受性和药代动力学。
4.LAG-3疗法+PD-1治疗肺癌Ⅱ期临床积极。Immutep公司LAG-3融合蛋白eftilagimod alpha(efti,IMP321)与默沙东PD-1抑制剂Keytruda联用,在治疗PD-1/PD-L1抑制剂经治、转移性非小细胞肺癌(NSCLC)患者的Ⅱ期临床TACTI-002获积极中期数据。联合治疗在这类难治性患者中达到36.1%的疾病控制率,6个月时的无进展生存率为26%;客观缓解率为5.6%,2例患者获得确认和持久的部分缓解;中位总生存期尚未达到。
5.Neuron23公司新一轮融资开发PD靶向疗法。精准神经病学研发公司Neuron23宣布完成1亿美元的C轮融资,用于推进其主打项目LRRK2抑制剂NEU-723在今年年底之前进入临床试验。NEU-723是一款能够穿越血脑屏障的潜在“best-in-class”疗法,拟开发用于治疗帕金森病。目前,Neuron23公司的研发管线中还包含多个靶向LRRK2和TYK2的在研化合物。
6.罗氏PD-L1+TIGIT组合III期肺癌临床失败。罗氏制药宣布,旗下基因泰克TIGIT抗体tiragolumab与PD-L1阿替利珠单抗的组合疗法,在一线治疗广泛期小细胞肺癌(ES-SCLC)的国际III期临床(SKYSCRAPER-02)中未达到无进展生存期(PFS)的共同主要终点,也没有达到总生存期 (OS)的共同主要终点,并且在计划的最终分析中不太可能达到统计学意义。罗氏表示将按计划继续推进该组合联合治疗非小细胞肺癌、食管鳞癌和其他癌症等III期临床。
医药热点
1.郑大一附院领导班子调整。3月29日下午,郑州大学第一附属医院召开干部大会,医院党委书记、院长王成增主持会议并宣布省委组织部相关任免决定:党委副书记赵杰兼任副院长,不再担任工会主席职务;宋永平、程敬亮、余祖江、张国俊任郑州大学第一附属医院副院长;由于年龄原因,孙莹璞、赵松不再担任郑州大学第一附属医院副院长职务。调整后的领导班子成员增至10人。
4.新冠病毒XE变异毒株问世。英国卫生与安全局(UKHSA)日前分析报道三种通过不同重组变异而来的毒株:XF、XE和XD重组毒株。其中,XF(Deltacron)是英国Delta和BA.1的重组,病例共38例,仅在英国2月中旬时发现,之后未再发现。XD(Deltacron)来自Omicron BA.1和Delta变体的重组,全球数据库只报告49例病例,其中大多数在法国。XE(Stealth Omicron)是Omicron BA.1和BA.2的组合,在英国已确认637例病例。目前XE毒株刚被发现,但已有数据称其传播速度可能比主流的Omicron高10%,其传染性可能比Omicron BA.2更强。
评审动态
2. FDA新药获批情况(北美03月29日)
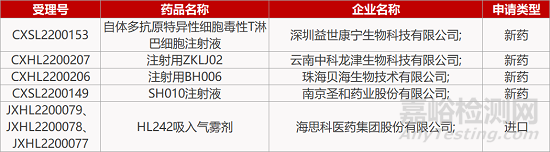


来源:药研发


